题目内容
【题目】已知 X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。
(1)由Y和Z组成,且Y和Z质量比为7∶20 的化合物的化学式(分子式)是_____________。
(2)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是_____________ 和_____________。
【答案】N2O5 OH- NH4+
【解析】
由X、Y、Z都是短周期的元素知,这三种元素的原子序数小于等于18;由X原子的电子层数与它的核外电子总数相同及结合核外电子排布规律得,X是H元素;由Z原子的最外层电子数是次外层的三倍及结合核外电子排布规律得,Z是O元素;由X、Y、Z都是短周期的元素,它们的原子序数依次递增,Y和Z可以形成两种以上气态化合物,知Y是N元素。
(1) Y和Z分别为N和O,其质量比为7∶20,则其原子个数之比为![]() =2:5,O元素的电负性大于N元素的电负性,该化学式氮元素在左边,氧元素在右边,故答案为:N2O5;
=2:5,O元素的电负性大于N元素的电负性,该化学式氮元素在左边,氧元素在右边,故答案为:N2O5;
(2)X2Z的化学式为:H2O,该分子有10个电子,由X、Y、Z中的两种元素组成,有10个电子的离子有:OH-和NH4+,故答案为:OH-;NH4+。

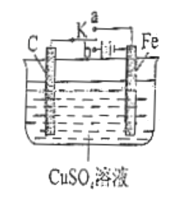
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
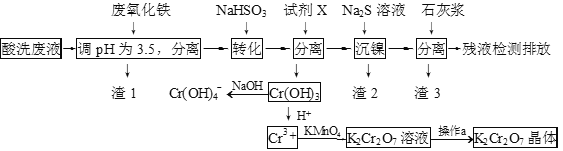
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
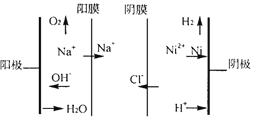
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。