题目内容
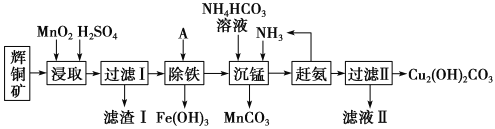
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
【答案】充分搅拌,将辉铜矿粉碎,加热等 SiO2、S、MnO2 3.7~5.6( 或3.7≤pH<5.6) 3H2O+2 Fe3++3CuO=2Fe(OH)3+3Cu2+(或Fe3++ 3H2OFe(OH)3+3H+ CuO+2H+=Cu2++ H2O ) 5 Mn2++HCO3-+NH3=MnCO3↓+NH4+ 0.02 10200
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜;据此分析解答本题。
(1)酸浸时,通过充分搅拌、将辉铜矿粉碎、加热等可以提高浸取速率;
(2)“浸取”时:Cu2S遇酸时会生成S,在硫酸酸性条件下MnO2氧化Cu2S得到CuSO4和MnSO4,Fe2O3和硫酸反应生成硫酸铁,SiO2不溶于硫酸,所以滤渣I中的主要成分是SiO2、S、MnO2;
(3)“除铁”主要是除去溶液中Fe3+,根据题干表格可知,若要使Fe3+完全沉淀而不沉淀Cu2+,溶液的pH范围为:3.7~5.6或3.7≤pH<5.6;加入CuO消耗氢离子,促进铁离子水解为氢氧化铁沉淀,“除铁”时所发生的反应3H2O+2Fe3++3CuO=2Fe(OH)3+3Cu2+,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,![]() 2.0×10-36,
2.0×10-36,![]() ,pH=5。
,pH=5。
(4)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(5)Na2CO3和BaSO4转化为BaCO3的离子方程式是CO32-+BaSO4=BaCO3+ SO42-,平衡常数K=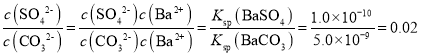 ;要使46.6g BaSO4恰好完全转化为BaCO3,生成0.2mol SO42-,则消耗0.2mol CO32-,根据溶液中
;要使46.6g BaSO4恰好完全转化为BaCO3,生成0.2mol SO42-,则消耗0.2mol CO32-,根据溶液中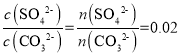 ,则溶液中CO32-的物质的量是10mol,设需要浓度为1mol·L-1Na2CO3溶液的体积是V,V×1-0.2=10,V=10.2L=10200mL。
,则溶液中CO32-的物质的量是10mol,设需要浓度为1mol·L-1Na2CO3溶液的体积是V,V×1-0.2=10,V=10.2L=10200mL。