题目内容
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
【答案】B
【解析】
A. 步骤③,氢气中氢元素化合价升高,氢气作还原剂,故A正确;
B. 硅用作计算机“芯片”,二氧化硅不能作计算机“芯片”,故B错误;
C. 步骤①是二氧化硅和碳在高温条件下反应生成硅和一氧化碳,反应的化学方程式为:SiO2+2C![]() Si+2CO↑,故C正确;
Si+2CO↑,故C正确;
D. 步骤①②③中,都有元素化合价改变,发生的反应都属于氧化还原反应,故D正确;
选B。

【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
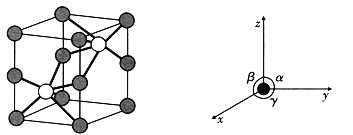
①基态Cl原子中,电子占据的最高电子层符号为 ______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素名称)。
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
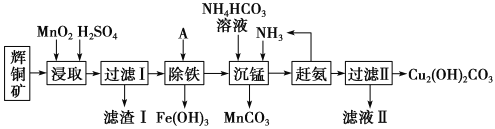
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)