题目内容
【题目】一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达为:K=![]() 。
。
根据题意完成下列填空:
(1)写出该反应的化学方程式___;若温度升高,K增大,该反应是___反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是___(选填编号)。
a.v正(H2O)=v逆(H2) b.容器中气体的相对分子质量不随时间改变
c.消耗nmol H2同时消耗nmolCO d.容器中物质的总物质的量不随时间改变
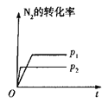
(3)该反应的v正 随时间变化的关系如图。t2时改变了某种条件,改变的条件可能是___、___。(填写2项)
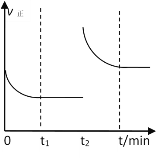
(4)实验测得t2时刻容器内有1molH2O,5min后H2O的物质的量是0.8mol,这5min内H2O的平均反应速率为___。
【答案】C(s)+H2O(g)CO(g)+H2(g) 吸热 ab 升高温度 增大水蒸汽的浓度 0.004mol/(L﹒min)
【解析】
(1)根据化学平衡常数表达式及元素守恒知,反应物还有C,所以该反应方程式为C(s)+H2O(g)CO(g)+H2(g);升高温度,平衡向吸热反应方向移动;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
(3)改变条件时反应速率增大,改变的条件可能是温度、压强、反应物浓度;
(4)反应速率=![]() 。
。
:(1)根据化学平衡常数表达式及元素守恒知,反应物还有C,所以该反应方程式为C(s)+H2O(g)CO(g)+H2(g);升高温度,平衡向吸热反应方向移动,K增大说明平衡正向移动,所以正反应是吸热反应,故答案为:C(s)+H2O(g)CO(g)+H2(g);吸热;
(2)a.当v正(H2O)=v逆(H2)=v逆(H2O)时,正逆反应速率相等,所以反应达到平衡状态,故正确;
b.反应前后气体的物质的量不相同,气体质量变化,容器中气体的平均相对分子质量不随时间变化即达到平衡,故正确;;
c.无论反应是否达到平衡状态都存在消耗nmolH2同时消耗nmolCO,所以不能据此判断平衡状态,故错误;
d.无论反应是否达到平衡状态容器中物质的总物质的量都不随时间改变,所以不能据此判断平衡状态,故错误;
故选ab;
(3)改变条件时反应速率增大,改变的条件可能是升高温度、增大压强、增大反应物浓度,故答案为:升高温度;增大水蒸汽的浓度;
(4)反应速率![]() ,故答案为0.004mol/(L﹒min)。
,故答案为0.004mol/(L﹒min)。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 ______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素名称)。
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
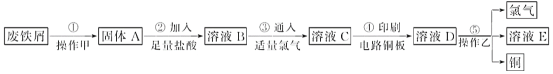
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
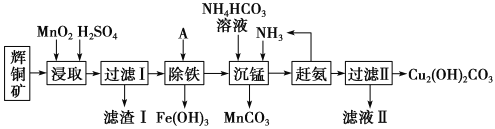
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)