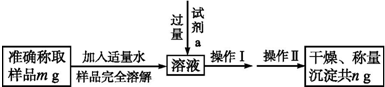
题目内容
3.(1)用系统命名法命名烃A:2,2,6-三甲基-4-乙基辛烷;烃A的一硝基取代物具有不同沸点的产物有10种.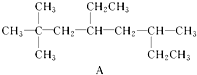
(2)
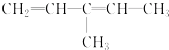 该烃系统命名为:3-甲基-1,3-戊二烯
该烃系统命名为:3-甲基-1,3-戊二烯(3)写出下列物质的结构简式:
①3-甲基-1-丁炔CH≡CC(CH3)2
②邻乙基苯乙烯
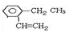 .
.
分析 (1)依据烷烃的命名原则命名:选取最长碳链,选取距离支链最近的一端命名为1号碳,该有机物有几种不同环境的H,则有几种一硝基取代物;
(2)二烯烃的命名选取含有2个碳碳双键的最长碳链;
(3)①3-甲基-1-丁炔为炔烃,最长碳链为4,在3号碳上含有1个甲基,三键位于1、2号碳之间;
②苯环上间位上的两个氢原子分别被乙基和乙烯基取代的产物,据此解答即可.
解答 解:(1) ,该有机物为烷烃,最长碳链含有8个C,主链为辛烷,编号从距离甲基最近的一端开始,甲基在2号C和6号C上各含有2个、1个,在4号C含有1个乙基,该有机物名称为:2,2,6-三甲基-4-乙基辛烷,该有机物中含有10种不同的H,那么就有10种一硝基取代物,
,该有机物为烷烃,最长碳链含有8个C,主链为辛烷,编号从距离甲基最近的一端开始,甲基在2号C和6号C上各含有2个、1个,在4号C含有1个乙基,该有机物名称为:2,2,6-三甲基-4-乙基辛烷,该有机物中含有10种不同的H,那么就有10种一硝基取代物,
故答案为:2,2,6-三甲基-4-乙基辛烷;10;
(2)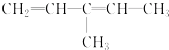 ,该有机物为二烯烃,最长碳链为5,即为戊二烯,碳碳双键分别在1、2和3、4之间,在3号碳上含有1个甲基,正确命名为:3-甲基-1,3-戊二烯,故答案为:3-甲基-1,3-戊二烯;
,该有机物为二烯烃,最长碳链为5,即为戊二烯,碳碳双键分别在1、2和3、4之间,在3号碳上含有1个甲基,正确命名为:3-甲基-1,3-戊二烯,故答案为:3-甲基-1,3-戊二烯;
(3)①3-甲基-1-丁炔为炔烃,最长碳链为4,在3号碳上含有1个甲基,三键位于1、2号碳之间,结构简式为:CH≡CC(CH3)2,故答案为:CH≡CC(CH3)2;
②邻乙基苯乙烯,苯环上间位上的两个氢原子分别被乙基和乙烯基取代,结构简式: ,故答案为:
,故答案为: .
.
点评 本题考查了有机物的命名、一硝基代物的判断方法,题目难度中等,解题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可.

练习册系列答案
相关题目
13.短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法错误的是
( )
( )
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
14..能正确表示下列反应的离子方程式的是( )
| A. | 钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 石灰石与醋酸溶液反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 溴化亚铁溶液中通入少量氯气2Br-+Cl2═Br2+2C1- | |
| D. | NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
18.将1.15gNa投入水中,若使每100个水分子中有一个Na+,则需水的质量为( )
| A. | 90g | B. | 90.9g | C. | 99g | D. | 9g |
8.
(1)电离平衡常数是衡量弱电解质电离程度强弱的量.上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为CH3COOH>H2CO3>HCN.
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为b>a>c.(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)>c(K+)-c(CH3COO-).(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈酸性(填“酸”、“碱”或“中”),用离子方程式表示原因NH4++H2O?NH3•H2O+H+
④室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示.b点所示溶液中的溶质是NH3•H2O、NH4Cl
⑤NH4HCO3溶液呈碱性(填“酸”、“碱”或“中”)
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式NaCN+H2O+CO2=HCN+NaHCO3.

| 化学式 | NH3•H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为b>a>c.(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)>c(K+)-c(CH3COO-).(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈酸性(填“酸”、“碱”或“中”),用离子方程式表示原因NH4++H2O?NH3•H2O+H+
④室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示.b点所示溶液中的溶质是NH3•H2O、NH4Cl
⑤NH4HCO3溶液呈碱性(填“酸”、“碱”或“中”)
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式NaCN+H2O+CO2=HCN+NaHCO3.
15.氯离子:①具有酸性 ②有酸味 ③遇水见光放出氧气 ④比氯原子少一个电子 ⑤比氯原子多一个电子 ⑥呈黄绿色 ⑦呈无色 ⑧有咸味 ⑨可以失去电子 ⑩能使淀粉-碘化钾试纸变蓝.说法一定正确的是( )
| A. | ⑤⑦⑨ | B. | ①⑤⑦⑨⑩ | C. | ①②③④⑥⑨ | D. | ③⑤⑥⑧⑨ |
12. 如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )
如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )
 如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )
如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )| A. | 甲、乙、丙都属于氧化还原反应 | |
| B. | 甲反应的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | 丙充分反应,能产生0.05 mol O2,转移电子0.1 mol | |
| D. | 甲、乙、丙充分反应后所得溶液的物质的量浓度为C1、C2、C3,则C1=C2=C3 |