题目内容
【题目】工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
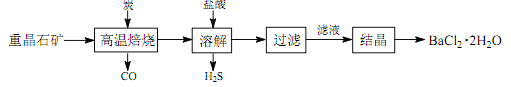
(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
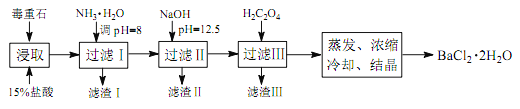
已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
【答案】 BaSO4+4C![]() 4CO↑+BaS 使 BaSO4得到充分的还原(或提高BaS的产量),反应为吸热反应,炭和氧气反应放热维持反应所需高温 将矿石粉碎,搅拌,适当升高温度等 Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4 过量会导致生成 BaC2O4沉淀,产品的产量减少
4CO↑+BaS 使 BaSO4得到充分的还原(或提高BaS的产量),反应为吸热反应,炭和氧气反应放热维持反应所需高温 将矿石粉碎,搅拌,适当升高温度等 Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4 过量会导致生成 BaC2O4沉淀,产品的产量减少 ![]()
【解析】途径 1:根据流程图,BaSO4和碳经过高温焙烧后生成CO和BaS,BaS和盐酸生成BaCl2。
(1)“高温焙烧”时反应的化学方程式:BaSO4+4C![]() 4CO↑+BaS ;
4CO↑+BaS ;
(2)“高温焙烧” 时必须加入过量的炭,使BaSO4得到充分的还原,同时还要通入空气,可以与CO反应,使得平衡向右移动,提高BaS的产量,同时,反应为吸热反应,炭和氧气反应放热维持反应所需高温;
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,观察流程图,矿石的浸取得到的滤液是氯化钡、Ca2+、 Mg2+、 Fe3+等的溶液,第一步调节pH沉淀掉Fe3+,第二步调节pH沉淀掉Mg2+,第三步加入草酸溶液沉淀掉Ca2+,最后得到BaCl2·2H2O。
(3)为提高矿石的浸取率,可采取的措施将矿石粉碎,搅拌,适当升高温度等;
(4)加入 NH3·H2O 调节 pH=8 可除去Fe3+,第二步调节pH到12.5时,Mg2+沉淀完全,部分Ca2+开始沉淀,所以得到的滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;因为BaC2O4也难溶于水,所以加入 H2C2O4时应避免过量,原因是H2C2O4 过量会导致生成 BaC2O4沉淀,产品的产量减少;
(5)经过重量法得到的沉淀即为n g BaSO4,根据钡元素守恒,n(Ba)=![]() ,n(BaCl2·2H2O)=
,n(BaCl2·2H2O)=![]() mol,m(BaCl2·2H2O)=
mol,m(BaCl2·2H2O)=![]() g,则 BaCl2·2H2O 的质量分数为
g,则 BaCl2·2H2O 的质量分数为![]() 。
。