题目内容
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH![]() 的电子式:
的电子式: ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C﹣H键都是氢原子的1s轨道与碳原子的p轨道形成的s﹣p σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s﹣sp3σ键
【答案】D
【解析】
试题分析:A.计算B原子价层电子对数、孤对电子数确定空间构型;
B.铵根离子是正四面体结构;
C.甲烷分子中C原子2s轨道与3个2p轨道发生sp3杂化,4个sp3杂化轨道与4个H原子的1s轨道形成σ键;
D.根据C中的分析进行判断.
解:A.BF3中B原子孤对电子数=![]() =0、价层电子对数=3+0=3,故其为平面正三角形,故A错误;
=0、价层电子对数=3+0=3,故其为平面正三角形,故A错误;
B.NH4+的电子式: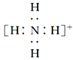 ,N原子呈4个N﹣Hσ键,没有孤电子对,故其正四面体结构,故B错误;
,N原子呈4个N﹣Hσ键,没有孤电子对,故其正四面体结构,故B错误;
C.甲烷分子中C原子2s轨道与3个2p轨道发生sp3杂化,4个sp3杂化轨道与4个H原子的1s轨道形成4个s﹣sp3σ键,故C错误;
D.由C中的分析可知,CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s﹣sp3σ键,故D正确,
故选D.

练习册系列答案
相关题目