题目内容
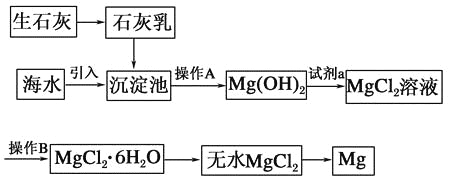
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。
【答案】(1)沉淀Mg2+[或使Mg2+形成Mg(OH)2沉淀] Mg2++2OH-===Mg(OH)2↓
(2)贝壳(或牡蛎壳等) (3)过滤 加热浓缩(或蒸发结晶)
(4)HCl (5)MgCl2(熔融)![]() Mg+Cl2↑ 制盐酸,循环使用
Mg+Cl2↑ 制盐酸,循环使用
【解析】
(1)石灰乳中的Ca(OH)2与海水中的镁盐发生复分解反应生成Mg(OH)2沉淀。
(2)海滩上贝壳的主要成分是CaCO3,可用于制取生石灰。
(3)从沉淀池中得到Mg(OH)2固体,应利用过滤操作,加热浓缩MgCl2溶液,可使其结晶出MgCl2晶体。
(4)溶解Mg(OH)2应用足量盐酸。
(5)MgCl2(熔融)![]() Mg+Cl2↑,Cl2可用于生产盐酸,循环利用。
Mg+Cl2↑,Cl2可用于生产盐酸,循环利用。

【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期第ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是____________(填元素符号),丁元素的最高正价为______________价。
(3)元素的最高价氧化物对应水化物中碱性最强的是_________(填化学式,下同), 呈两性的氢氧化物是__________________,酸性最强的是__________________。
(4)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(5)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。请写出中和胃酸的离子方程式:_________________________。