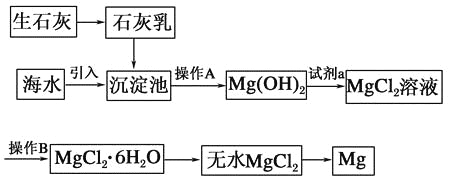
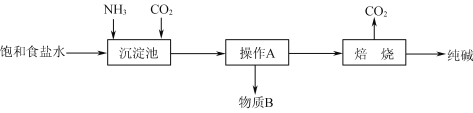
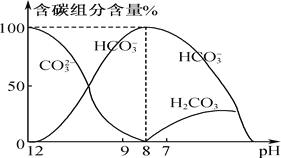
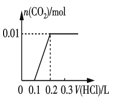
题目内容
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
B. 22.4L N2与CO组成的混合气体所含有的电子数为14NA
C. 0.1mol/L K2CO3溶液中所含K+数目为0.2NA
D. 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
【答案】A
【解析】
A、NO2和N2O4的最简式相同,计算9.2 g NO2中所含氮原子数=![]() ×1×NA=0.2NA,选项A正确;
×1×NA=0.2NA,选项A正确;
B.没有指明气体是否处于标准状况下,则不能确定22.4L的CO气体的物质的量,无法确定二者的关系,选项B错误;
C.溶液的体积未知,无法计算K+数目,选项C错误;
D、根据价态归中规律分析该反应电子转移的方向和数目知生成3molCl2转移5mol电子,选项D错误;
答案选A。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试回答下列问题。
(1)F中所含官能团的名称是_____________________________________。
(2)G的结构简式为___________________________。
(3)写出D→E的化学方程式,并注明反应类型:____________________________。
(4)F→G的反应装置如图所示:

a.图中倒置球形干燥管的作用_____________________________;
b.试管Ⅱ中加有饱和Na2CO3溶液,其作用是: ____________________;
c.具有一个羟基的化合物M 10 g,与F反应生成产物11.85 g,并回收了未反应的M 1.3 g,则M的相对分子质量为____;
(5)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ,再测有机物层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管II中试剂 | 有机层的厚度/cm |
A | 2ml乙醇、1ml乙酸、1ml18mol/L浓硫酸 | 饱和碳酸钠溶液 | 3.0 |
B | 2ml乙醇、1ml乙酸、 | 0.1 | |
C | 2ml乙醇、1ml乙酸、3ml 2mol/L硫酸 | 0.6 | |
D | 2ml乙醇、1ml乙酸、3ml 1mol/L硫酸 | 0.3 |
a.实验D与实验C相对照可证明___________________________________________________。
b.分析实验A、C的数据,可以推测出浓硫酸的__________提高了乙酸乙酯的产率。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水
②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸
③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸
④混合物中各物质的浓度不再变化
(7)写出G的一种同分异构体(与G同类)的结构简式:_______________。