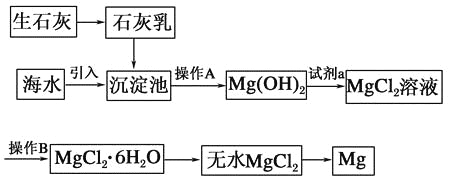
题目内容
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期第ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是____________(填元素符号),丁元素的最高正价为______________价。
(3)元素的最高价氧化物对应水化物中碱性最强的是_________(填化学式,下同), 呈两性的氢氧化物是__________________,酸性最强的是__________________。
(4)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(5)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。请写出中和胃酸的离子方程式:_________________________。
【答案】 Al 16 第三周期第ⅦA族 Na +7 NaOH Al(OH)3 HClO4 > < Al(OH)3+3H+=Al3++3H2O
Al 16 第三周期第ⅦA族 Na +7 NaOH Al(OH)3 HClO4 > < Al(OH)3+3H+=Al3++3H2O
【解析】
11号元素甲是钠元素,核外有11个电子;元素乙位于第三周期第ⅢA族,乙是Al元素;丙是S元素,原子序数是16;元素丁的原子结构示意图是![]() ,质子数的17,丁为Cl元素。
,质子数的17,丁为Cl元素。
(1)①甲是钠元素,核外有11个电子,原子结构示意图是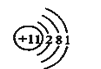 ;②乙位于第三周期第ⅢA族,原子序数是13,元素符号是Al;③丙是S元素,原子序数是16;④丁是Cl元素,在周期表的第三周期第ⅦA族。
;②乙位于第三周期第ⅢA族,原子序数是13,元素符号是Al;③丙是S元素,原子序数是16;④丁是Cl元素,在周期表的第三周期第ⅦA族。
(2)同周期元素从左到右半径逐渐减小,Na、Al、S、Cl四种元素中,原子半径最大的是Na,元素的最高正价等于最外层电子数,氯原子最外层有7个电子,最高正价为+7价。
(3)同周期元素从左到右金属性减弱,元素金属性越强最高价氧化物对应水化物的碱性越强,最高价氧化物对应水化物中碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;同周期元素从左到右非金属性增强,元素非金属性越强最高价氧化物对应水化物的酸性越强,酸性最强的是HClO4。
(4)钠的金属性大于铝,最高价氧化物对应水化物的碱性:甲>乙,元素非金属性越强,简单气态氢化物的稳定性越强,非金属性S<Cl,所以稳定性:丙<丁。
(5)元素Al的最高价氧化物对应水化物是Al(OH)3 ,胃酸的成分是盐酸,反应的离子方程式是Al(OH)3+3H+=Al3++3H2O。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案