题目内容
9.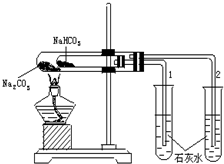 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:(1)加热一段时间后,两试管中石灰水的变化是C(填序号).
A.均变浑浊
B.试管1澄清,试管2变浑浊
C.试管2澄清,试管1变浑浊
(2)该实验说明二者的稳定性强的是Na2CO3,另一种物质受热分解的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)实验结束时的正确操作是①(填序号)
①先将导管从液体中移出,再熄灭酒精灯 ②先熄灭酒精灯,再将导管从液体中移出
(4)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是A
A.通入二氧化碳气体B.加入氢氧化钡溶液C.加入澄清石灰水D.加入稀盐酸.
分析 (1)加热碳酸钠,碳酸钠不分解;加热碳酸氢钠,碳酸氢钠分解生成二氧化碳,二氧化碳能使澄清石灰水变浑浊;
(2)温度较高但不分解的物质较稳定,加热时碳酸氢钠分解生成碳酸钠、水和二氧化碳;
(3)实验结束时,为了避免发生倒吸现象,应该先将导管从液体中移出,再熄灭酒精灯;
(4)除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质;溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂.
解答 解:(1)如果直接加热的物质不分解,而间接加热的物质分解,就能证明物质的稳定性,碳酸氢钠易分解,所以小试管中盛放的是碳酸氢钠,大试管中盛放的是碳酸钠,碳酸氢钠分解生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,碳酸钠不分解,不能使澄清的石灰水变浑浊,所以看到的现象是试管2澄清,试管1变浑浊,
故答案为:C;
(2)该实验中,直接加热的碳酸钠不分解,但间接加热的碳酸氢钠分解,所以说明二者中热稳定性强的物质是Na2CO3,碳酸氢钠在加热条件下分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:Na2CO3;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)如果先熄灭酒精灯,再将导管从液体中移出,会发生倒吸现象,应该先撤出导管,然后再熄灭酒精灯,所以①正确,
故答案为:①;
(4)A.向Na2CO3中通入二氧化碳,会反应生成碳酸氢钠溶液,达到除杂的目的,CO2+H2O+CO32-=2HCO3-,故A正确;
B.加入氢氧化钡溶液,碳酸氢钠会反应生成碳酸钡沉淀,碳酸钠与氢氧化钡反应也生成碳酸钡,故B错误;
C.加入澄清石灰水,碳酸氢钠和碳酸钠都会反应生成碳酸钙沉淀,故C错误;
D.加入稀盐酸,碳酸氢钠和碳酸钠都会反应生成氯化钠、二氧化碳和水,故D错误;
故答案为:A.
点评 本题考查了碳酸钠、碳酸氢钠的化学性质,题目难度中等,注意掌握碳酸钠、碳酸氢钠的热稳定性大小,明确常见的化学实验基本操作方法及除杂原则.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| B. | 常温常压下,28g乙烯和丙烯的混合气体中所含碳原子数目小于NA | |
| C. | 乙炔的摩尔质量为26g | |
| D. | 标准状态下,将22.4L乙醇溶于水后配成500mL溶液,所得溶液物质的量浓度为2 mol/L |
| A. | CO2 | B. | BF3 | C. | PCl5 | D. | HCl |
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物的密度随着相对分子质量增大逐渐增大 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应,它们燃烧时生成二氧化碳和水 | |
| D. | 烷烃同系物都能使溴水、KMnO4溶液褪色 |
| A. | CH3Cl | B. | (CH3)3CCH2OH | C. | (CH3)3CCl | D. | 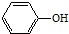 |
| A. | ③④⑥ | B. | ④⑥⑦ | C. | ④⑤⑧ | D. | ③⑥⑦ |
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把要保护的金属与直流电负极相连,这种方法叫牺牲阳极的阴极保护法 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
 .
. .
.
 .写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;
.写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;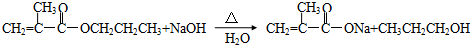 .
.