题目内容
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑
2UF4·NH4F+3NH3↑+4H2O↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
②物质 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
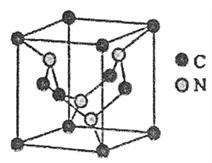
①晶胞中C原子的配位数为______。该晶体硬度超过金刚石的原因是_________。
②已知该晶胞的密度为dg/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为_______(用含d、r1、r2、NA的代数式表示,不必化简)。
【答案】 4  BCD 3 CH4、SiH4、GeH4 BH4-、AlH4- 3:2 H2O<NH3<CO2 4 该晶体和金刚石二者均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度较金刚石大
BCD 3 CH4、SiH4、GeH4 BH4-、AlH4- 3:2 H2O<NH3<CO2 4 该晶体和金刚石二者均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度较金刚石大 
【解析】(1)第四周期中未成对电子数为2的元素有22Ti、28Ni、32Ge、34Se共四种;原子序数为镁元素的二倍的元素是24号元素Cr,其基态价电子排布图为![]() 。
。
(2)①已知HF2-的结构为[F-H…F]-,所以NH4HF2为离子化合物,即类似于铵盐,所以含有的化学键有离子键、共价键和配位键,即正确选项为BCD;②根据同周期元素的第一电离能从左到右呈增大趋势的一般规律,结合N原子最外层2p能级上呈半满状态,导致其第一电离能比氧元素的大,所以与氧同周期,且第一电离能比氧大的元素有N、F和Ne三种。
(3)①已知NH4+是含有5个原子8个价电子的微粒,与其互为等电子体的分子有CH4、 SiH4 、GeH4等,互为等电子体的离子有BH4-、AlH4-;② 已知CO32-中碳原子杂化类型为sp2,则物质 中碳原子是sp2杂化的有6个,是sp3杂化的有3个,是sp杂化的有1个,所以杂化类型相同和不同的碳原子个数之比为6:4,即3:2;③分解所得的气态化合物有NH3,是sp3杂化的三角锥形,有1个孤对电子,CO2是sp2杂化的直线型,没有孤对电子,H2O是sp3杂化的V型结构,有2个孤对电子,根据杂化类型,结合电子对互斥原理可知,它们的键角由小到大的顺序为H2O<NH3<CO2。
中碳原子是sp2杂化的有6个,是sp3杂化的有3个,是sp杂化的有1个,所以杂化类型相同和不同的碳原子个数之比为6:4,即3:2;③分解所得的气态化合物有NH3,是sp3杂化的三角锥形,有1个孤对电子,CO2是sp2杂化的直线型,没有孤对电子,H2O是sp3杂化的V型结构,有2个孤对电子,根据杂化类型,结合电子对互斥原理可知,它们的键角由小到大的顺序为H2O<NH3<CO2。
(4)①该晶胞中与C原子最近的原子为N原子,与C原子最近且等距的N原子位于1/8小立方体的中心,且只有4个,1个C原子只能与4个N原子形成4个共价单键,所以C原子的配位数为4;该晶体硬度超过金刚石的原因是二者都是原子晶体,但该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,所以硬度比金刚石的大;②由晶胞结构可知,该晶胞中含有的C原子=![]() ,含有的N原子=4,所以其化学式为C3N4,则该分子的体积为[
,含有的N原子=4,所以其化学式为C3N4,则该分子的体积为[![]() ]cm3,由晶胞的密度和化学式可得该晶胞的体积为
]cm3,由晶胞的密度和化学式可得该晶胞的体积为![]() cm3,所以该晶胞的空间利用率为
cm3,所以该晶胞的空间利用率为 ×100%。
×100%。

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
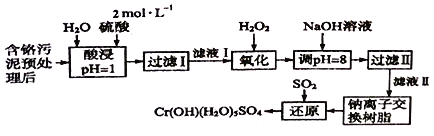
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有_________________(写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________(填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________,交换后溶液中浓度明显增大的离子为________________。