题目内容
13.已知在常温下,将NaOH溶液和一元酸HA溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:| 实验编号 | c(NaOH)/mol•L-1 | c(HA)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | 0.4 | 0.4 | pH=9 |
| 丙 | 0.4 | c1 | pH=7 |
| 丁 | 0.2 | 0.4 | pH<7 |
| A. | 在乙组混合溶液中c(OH-)-c(HA)=10-9mol•L-1 | |
| B. | c1<0.4 | |
| C. | a>9 | |
| D. | 在丁组混合液中c(Na+)>c(A-)>c(H+)>c(OH-) |
分析 由表中乙组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,溶液为NaA溶液,溶液pH=9,呈碱性,故HA为弱酸,
A.pH=9NaA溶液中c(H+)=10-9mol/L,溶液中氢氧根来源与水的电离与A-的水解.
B.一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应时溶液pH=9,丙组溶液呈中性,则酸应过量些;
C.A、由表中甲组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,NaA溶液浓度为乙组NaA溶液浓度的一半,浓度对溶液的碱性影响大于电离程度;
D.溶液pH<7,则c(OH-)<c(H+),再结合溶液呈电中性判断.
解答 解:根据乙组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,溶液为NaA溶液,溶液pH=9,呈碱性,故HA为弱酸,
A.pH=9的NaA溶液中c(H+)=10-9mol/L,氢氧根来源与水的电离与A-的水解,水每电离产生1个氢离子同时产生1个氢氧根离子,A-水解,生成1个HA分子同时生成1个氢氧根离子,所以溶液中c(OH-)=c(AH)+c(H+),故混合液中c(OH-)-c(HA)=10-9mol/L,故A正确;
B.一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,溶液pH=9,由表中数据可知丙组溶液呈中性,酸HA应过量些,故c1>0.4,故B错误;
C.由表中甲组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应,NaA溶液浓度为乙组NaA溶液浓度的一半,浓度对溶液的碱性影响大于电离程度,碱性比乙组的碱性弱,则pH<9,即:a<9,故C错误;
D.溶液呈电中性,一定存在c(OH-)+c(A-)=c(Na+)+c(H+),溶液pH<7,则c(OH-)<c(H+),所以c(A-)>c(Na+),故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,根据表中数据正确判断HA为弱酸为解答关键,注意掌握酸碱混合的定性判断方法,能够根据盐的水解原理、电荷守恒等知识正确判断各离子浓度大小.

| A. | 常温下18g 铝放入足量浓硫酸中转移电子数2NA | |
| B. | 0.1mol•L-1的稀硫酸中含有H+个数为0.2NA | |
| C. | 常温常压下48g的O3中含有氧原子数为3NA | |
| D. | 1.8g NH4+中含有的电子数为0.1NA |
| A. | 120kJ | B. | 100kJ | C. | 90kJ | D. | 60kJ |
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 制取乙酸乙酯时加入浓硫酸作催化剂可加快酯化反应的速率 | |
| D. | 实验室制取H2时,常用锌粒代替锌粉以降低反应的速率 |
| A. | CH4 | B. | C2H4 | C. | C6H6 | D. | C3H6 |
| A. | 软脂酸和油酸互为同系物 | |
| B. | 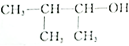 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| C. | 苯酚能与溴水反应,苯不能与溴水反应,说明羟基对苯环有影响 | |
| D. | 与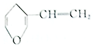 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 |
| A. | 石油分馏和煤的液化均为物理变化 | |
| B. | 石油裂解的目的是为了提高汽油等轻质油的产量和质量 | |
| C. | 石油分馏实验中,温度计水银球插入石油中但不能碰到瓶壁 | |
| D. | 煤干馏得到的煤焦油中可以分离出苯、甲苯等有机物 |
Ⅰ.配制 0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,配制溶液需要用250ml容量瓶,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 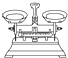 | 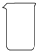 |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中平均温度差的空格:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 请填写(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(保留小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填序号)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是A
A.Q2>Q3>Q1 B.Q2>Q1>Q3 C.Q1=Q2=Q3 D.Q2=Q3>Q1.
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子 | |
| C. | 2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |