题目内容
12.A是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.(1)A的结构简式为:CH2=CH2;
(2)B、D分子中的官能团名称分别为醇羟基、羧基;
(3)写出下列反应的反应类型:①加成反应、④酯化反应或取代反应;
(4)写出下列反应的化学方程式:②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、④CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(5)A在一定条件下可聚合生成一种生成一种常见塑料,合成该塑料的化学方程式为
 ;
;(6)在石油工业中,A可由丁烷(C4H10)裂解得到,丁烷的一氯代物有4种同分异构体.
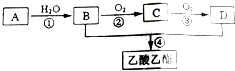
分析 A是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,A和水发生加成反应生成B,B为CH3CH2OH,B和D反应生成乙酸乙酯,则D为CH3COOH,乙醇被催化氧化生成乙醛、乙醛被氧化生成乙酸,所以C为CH3CHO,据此分析解答.
解答 解:A是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,A和水发生加成反应生成B,B为CH3CH2OH,B和D反应生成乙酸乙酯,则D为CH3COOH,乙醇被催化氧化生成乙醛、乙醛被氧化生成乙酸,所以C为CH3CHO,
(1)通过以上分析知,A的结构简式为:CH2=CH2,故答案为:CH2=CH2;
(2)B是乙醇、D是乙酸,所以B、D分子中的官能团名称分别为醇羟基、羧基,故答案为:醇羟基;羧基;
(3)根据以上分析知,①是乙烯和水的加成反应,④是乙酸和乙醇的酯化反应或取代反应,
故答案为:加成反应;酯化反应或取代反应;
(4)②为乙醇的催化氧化反应生成乙醛,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、④为乙醇和乙酸的酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(5)乙烯发生加聚反应生成聚乙烯塑料,合成该塑料的化学方程式为 ,故答案为:
,故答案为: ;
;
(6)在石油工业中,A可由丁烷(C4H10)裂解得到,丁烷的一氯代物有1-氯正丁烷、2-氯丁烷、2-甲基-2-氯丙烷、2-甲基-1-氯丙烷四种同分异构体,故答案为:4.
点评 本题考查有机物推断,为高频考点,以烯烃、醇、醛、羧酸、酯之间的转化为载体进行推断,明确官能团及其性质关系即可解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 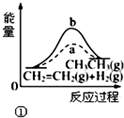 图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+△Q,0<△Q;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 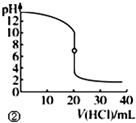 图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 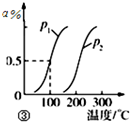 图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)+△Q,反应CH4的转化率与温度、压强的关系,且p1>p2、0<△Q | |
| D. | 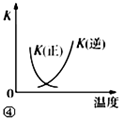 图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)+△Q,0<△Q;正、逆反应的平衡常数K随温度的变化 |
| A. | 常温下18g 铝放入足量浓硫酸中转移电子数2NA | |
| B. | 0.1mol•L-1的稀硫酸中含有H+个数为0.2NA | |
| C. | 常温常压下48g的O3中含有氧原子数为3NA | |
| D. | 1.8g NH4+中含有的电子数为0.1NA |
| A. | 一定温度下,向AgCl的饱和溶液中加入NaCl晶体,Ksp(AgCl)增大 | |
| B. | NH4Cl溶液中存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 | |
| D. | 某温度下,KW=1×10-12,则pH=11的氨水中,c(OH-)=1×10-8mol/L |
| A. | 向稀硝酸中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 氯气通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO22-+4NH4++2H2O | |
| D. | 向水中加入Na2O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| A. | v(B)=0.03mol•L-1•s-1 | B. | v(B)=0.045mol•L-1•s-1 | ||
| C. | v(C)=0.03mol•L-1•s-1 | D. | v(C)=0.06mol•L-1•s-1 |
| A. | 120kJ | B. | 100kJ | C. | 90kJ | D. | 60kJ |
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 制取乙酸乙酯时加入浓硫酸作催化剂可加快酯化反应的速率 | |
| D. | 实验室制取H2时,常用锌粒代替锌粉以降低反应的速率 |
Ⅰ.配制 0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,配制溶液需要用250ml容量瓶,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中平均温度差的空格:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 请填写(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(保留小数点后一位).
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填序号)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-Q2 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是A
A.Q2>Q3>Q1 B.Q2>Q1>Q3 C.Q1=Q2=Q3 D.Q2=Q3>Q1.