题目内容
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4。请回答下列问题:
(1)F的稳定价态离子的电子排布式是________________,A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________,分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是______________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强的是________(用具体的化学键表示)。
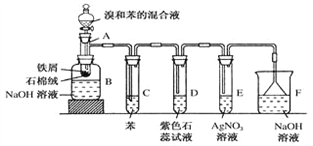
(4)如图所示的晶胞是由A、D两元素组成的,下列有关该晶体的说法中正确的是________。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
【答案】(1)1s22s22p63s23p63d5或[Ar]3d5 Si<C<O<N
(2)sp3 三角锥形 NH3与H2O分子间易形成氢键
(3)CO (4)c
【解析】由已知①知F为铁元素;由已知③知A、D分别是第ⅣA、ⅥA族元素,结合几种元素原子序数关系及已知②可判断A是碳元素、D是氧元素、E是硅元素、B是氮元素。(4)由所给晶胞图知该晶体属于原子晶体,组成仍为CO2,碳、氧之间形成单键,因CO键键长比SiO键短,故该CO2原子晶体的熔点可能比SiO2高且不溶于水。

练习册系列答案
相关题目