��Ŀ����
����Ŀ����A���ijЩ���ʼ��仯���ﳣ��������̫���ܵ�ء��뵼����ϵȡ�
(1)��̬ʱ��ԭ�Ӻ���ĵ����Ų�ʽΪ____________��
(2)����������ͬ����,����Ԫ�صĵ�һ�����ܴӴ�С˳��Ϊ____________(��Ԫ�ط��ű�ʾ)��
(3)��̬SeO3���ӵ�����ṹΪ____________,��SeO3��Ϊ�ȵ������һ������Ϊ____________(�ѧʽ)��
(4)��Ԫ�ؾ���ȱ������,����仯�����������мӺ��ԡ�
������(H3BO3)��һԪ����,д��������ˮ��Һ�еĵ��뷽��ʽ____________��
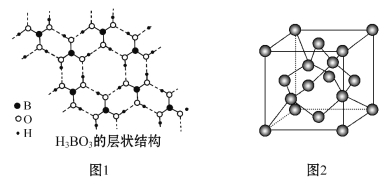
������(H3BO3)��һ�־���Ƭ��ṹ�İ�ɫ����,���ڵ�H3BO3���Ӽ�ͨ���������(��ͼ1)����1 mol H3BO3�ľ�������____________mol���,____________mol�Ҽ���H3BO3��B��ԭ���ӻ�����Ϊ____________��
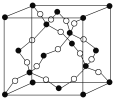
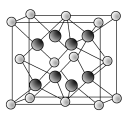
(5)���ij�ֵ��ʵľ�����ͼ2��ʾ�����ù辧����ܶ�Ϊ��g��cm-3,�����ӵ�����ֵΪNA,�����������������ԭ��֮��ľ���Ϊ________cm(�ô���ʽ��ʾ����)
���𰸡�(1)1s22s22p63s23p63d104s24p3(��[Ar]3d104s24p3)
(2)Br>As>Se
(3)ƽ�������� C![]() ��N
��N![]()
(4)��H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
��3 6 sp2
(5)![]() ��
��![]()
��������(1)����33��Ԫ��,����ԭ�Ӻ�������Ų����ɿ���д�������Ų�ʽΪ1s22s22p63s23p63d104s24p3(��[Ar]3d104s24p3)��
(2)As��Se��Br����ͬһ������ԭ������������,������Ԫ���������ڵڢ�A�塢�ڢ�A�塢�ڢ�A��,�ڢ�A��Ԫ�ش���������Ԫ�صĵ�һ������,����3��Ԫ�صĵ�һ�����ܴӴ�С˳��ΪBr>As>Se��
(3)��̬SeO3����������ԭ�ӵļ۲���Ӷ���Ϊ![]() =3,�µ��Ӷ�,���Է��ӹ���Ϊƽ��������,����Ϊ�ȵ�����Ҫ��ԭ��������ͬ,�۵���������ͬ,������SeO3��Ϊ�ȵ������һ������ΪC
=3,�µ��Ӷ�,���Է��ӹ���Ϊƽ��������,����Ϊ�ȵ�����Ҫ��ԭ��������ͬ,�۵���������ͬ,������SeO3��Ϊ�ȵ������һ������ΪC![]() ��N
��N![]() ��
��
(4)������ΪһԪ����,��ˮ��Һ��������������,����뷽��ʽΪH3BO3+H2O![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
�ڸ���1������������γ�3�����,1������������γ�6���Ҽ�,��1 mol H3BO3�ľ�����������ʵ�����3 mol,�Ҽ���6 mol;
����ͼ֪,����(H3BO3)��ÿ����ԭ������3����ԭ���Ҳ����µ��Ӷ�,�ݴ�ȷ����ԭ���ӻ���ʽΪsp2��
(5)�þ�����Si����=8��![]() +6��
+6��![]() +4=8,�ʾ�������Ϊ
+4=8,�ʾ�������Ϊ![]() g=
g=![]() g,�辧����ܶ�Ϊ��g��cm-3,���ⳤ=
g,�辧����ܶ�Ϊ��g��cm-3,���ⳤ=![]() cm,����Խ��߳���Ϊ
cm,����Խ��߳���Ϊ![]() ��
��![]() cm,�������������ԭ��֮��ľ���Ϊ
cm,�������������ԭ��֮��ľ���Ϊ![]() ��
��![]() cm��
cm��![]() =
=![]() ��
��![]() cm��
cm��