题目内容
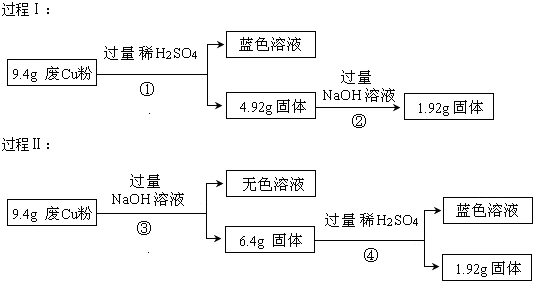
【题目】某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究: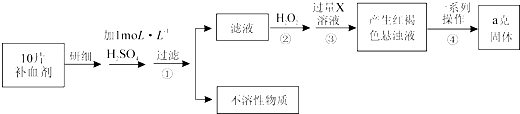
请回答下列问题:
(1)Ⅰ.①实验时用10molL﹣1的浓硫酸,配制100mL 1molL﹣1 H2SO4溶液,所需浓硫酸的体积为mL;②下列操作中,容量瓶所具备的功能有(填序号);
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体 D.用来溶解固体溶质
③在下列配制过程示意图中,有错误的是(填写序号);
④下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
(2)Ⅱ.①步骤②加入过量H2O2后,溶液中主要存在的金属阳离子是;②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:a. , b.洗涤,c.灼烧,d.冷却
③若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为g.
【答案】
(1)10;A;①④;AC
(2)Fe3+;过滤;0.19a
【解析】(1)解:Ⅰ.①浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10﹣3×1mol/L=10mol/L×V,解得V=10.0mL,所以答案是:10.0;②容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,所以答案是:A;③稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,所以答案是:①④;④A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确; B.未冷却体积偏小,浓度偏大,故B错误;C.定容时仰视,体积偏大,浓度偏小,故C正确;所以答案是:AC;(2)Ⅱ.①步骤②加入过量H2O2将Fe2+氧化为Fe3+ , 所以溶液中主要存在的金属阳离子是Fe3+ , 所以答案是:Fe3+;②由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,所以答案是:过滤;③ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量: ![]() =0.07ag,含硫酸亚铁的质量为:
=0.07ag,含硫酸亚铁的质量为: ![]() =0.19ag,所以答案是:0.19a.
=0.19ag,所以答案是:0.19a.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.以下是用过氧化氢法生产亚氯酸钠的工艺流程图: 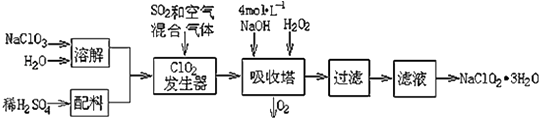
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O;
②Ksp(FeS)=6.3×10﹣18; Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=2.4×10﹣28
(1)吸收塔内发生反应的离子方程式为 . 该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2 . 若用二氧化氯和浓盐酸制取Cl2 , 当生成5mol Cl2时,通过还原反应制得氯气的质量为g.
(2)从滤液中得到NaClO23H2O晶体的所需操作依次是(填写序号). a.蒸馏 b.灼烧 c.过滤 d.冷却结晶 e.蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1),此时体系中的S2﹣的浓度为 .