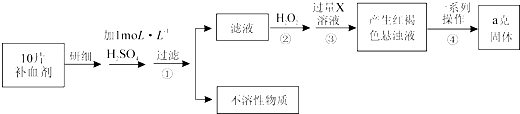
题目内容
【题目】某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO45H2O,实现废物综合利用.他们进行了两组实验,过程如下: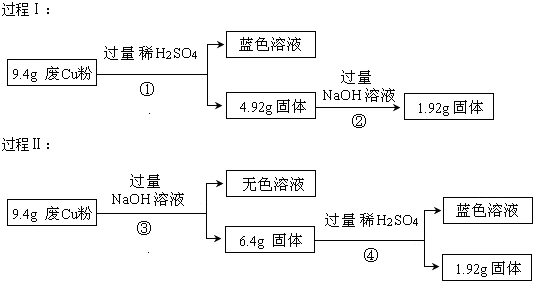
(1)废Cu粉中一定含有的杂质是(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:①;
③;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)= , m(Cu)= .
【答案】
(1)SiO2、Fe2O3
(2)Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO2﹣+H2O
+H2O、Al2O3+2OH﹣=2AlO2﹣+H2O
(3)3.0g;3.2g
【解析】解:由过程Ⅰ可知,9.4gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.92g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.92g固体只含Cu;由过程Ⅱ可知,9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ , 说明溶液中一定存在Fe2+、H+、Cu2+ , 1.92g固体为铜,所以没有Fe3+ , (1)由过程Ⅰ可知含有SiO2 , 由过程Ⅱ可知含有Fe2O3 , 所以答案是:SiO2、Fe2O3;(2)由I可知X中一定存在的是Cu、Fe2O3、Al2O3 , 离子方程式分别为Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ , ③涉及反应有SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO
+H2O、Al2O3+2OH﹣=2AlO ![]() +H2O,所以答案是:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO
+H2O,所以答案是:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH﹣═SiO ![]() +H2O、Al2O3+2OH﹣=2AlO
+H2O、Al2O3+2OH﹣=2AlO ![]() +H2O;(3)通过以上分析可知,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.4g,设Fe2O3为xmol,Cu为ymol, 则160x+64y=6.4
+H2O;(3)通过以上分析可知,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.4g,设Fe2O3为xmol,Cu为ymol, 则160x+64y=6.4
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ ,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y﹣x)mol×64g/mol=1.92g,
解得:x=0.02,y=0.05,
则Fe2O3的质量为0.02mol×160g/mol=3.2g,
Cu的质量为0.05mol×64g/mol=3.2g,
所以答案是:3.0g;3.2g.

 名校课堂系列答案
名校课堂系列答案