��Ŀ����
����Ŀ���������ƣ�NaClO2��������ˮ��������ɰ�ǡ���֬��Ư����ɱ�����������ù������ⷨ�����������ƵĹ�������ͼ�� 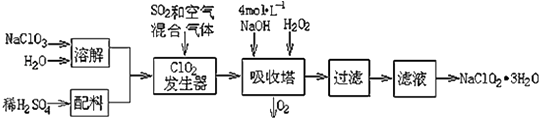
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
��Ksp��FeS��=6.3��10��18�� Ksp��CuS��=6.3��10��36��Ksp��PbS��=2.4��10��28
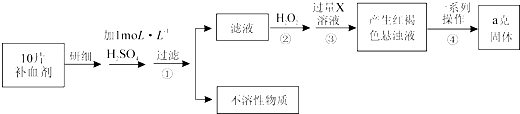
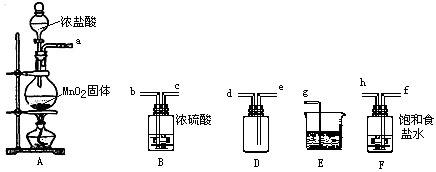
��1���������ڷ�����Ӧ�����ӷ���ʽΪ �� �ù��������е�NaClO3��ClO2��NaClO2����ǿ�����������Ƕ��ܺ�Ũ���ᷴӦ��ȡCl2 �� ���ö������Ⱥ�Ũ������ȡCl2 �� ������5mol Cl2ʱ��ͨ����ԭ��Ӧ�Ƶ�����������Ϊg��
��2������Һ�еõ�NaClO23H2O����������������������д��ţ��� a������ b������ c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ�����������ƣ�NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2 �� ���� 25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
���� | HClO2 | HF | HCN | H2S |
Ka | 1��10��2 | 6.3��10��4 | 4.9��10��10 | K1=9.1��10��8 |
�ٳ����£����ʵ���Ũ����ȵ�NaClO2��NaF��NaCN��Na2S������Һ��pH�ɴ�С��˳��Ϊ���û�ѧʽ��ʾ���������ȣ����ʵ���Ũ����ͬ��NaF��NaCN����Һ�������������������Ĵ�С��ϵΪ�����ǰ�ߴ���ȡ����ߴ���
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij������������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1������ʱ��ϵ�е�S2����Ũ��Ϊ ��
���𰸡�
��1��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2��71
��2��dc
��3��pH��Na2S����pH��NaCN����pH��NaF����pH��NaClO2����ǰ�ߴ�CuS��6.3��10��13mol/L
���������⣺��1.������������Ϣ��֪��������������NaClO2 �� ����һ����ClO2��NaClO2 �� ���ϼ۽��ͣ�����ԭ����H2O2�ض�����������������������Ӧ����ʽΪ��2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2 �� ��Ӧ��ClO2����������������ԭ��Ӧ��HCl�ǻ�ԭ��������������Ӧ�����ݵ���ת���غ��֪4n��ClO2��=n��HCl������n��ClO2����n��HCl��=1��4���ʻ�ԭ�����������������ʵ���֮��Ϊ1��4���ʻ�ԭ��Ӧ���ɵ�����Ϊ5mol�� ![]() =1mol��ͨ����ԭ��Ӧ�Ƶ�����������Ϊ1mol��71g/mol=71g�� ���Դ��ǣ�2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2��71��
=1mol��ͨ����ԭ��Ӧ�Ƶ�����������Ϊ1mol��71g/mol=71g�� ���Դ��ǣ�2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2��71��
��2.������Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ������Ũ������ȴ�ᾧ������ͨ�����˵õ��־��壬���Բ���˳��Ϊdc�����Դ��ǣ�dc��
��3.���ٸ��ݵ���ƽ�ⳣ����֪����ǿ��˳��Ϊ��HClO2��HF��HCN��HS�� �� ����Խ������Ӧ�������������ˮ��̶�Խ����Һ��PHԽ�����ʵ���Ũ����ȸ���ҺpH��ϵΪ��pH��Na2S����pH��NaCN����pH��NaF����pH��NaClO2����
NaF��NaCN����Һ��������Ũ����ͬ�����������Ӷ��ǩ�1�����ӣ�1mol������ˮ��õ�1mol���������ӣ������ӵ���Ũ�Ȳ��䣬����Һ����������Ũ����ͬ����ҺΪ���ԣ�pH��NaCN����pH��NaF������NaCN��Һ��������Ũ�Ƚ�С��������������������С����NaF��Һ���������������ϴ�
���Դ��ǣ�pH��Na2S����pH��NaCN����pH��NaF����pH��NaClO2����ǰ�ߴ�
���������������ͬ���ܶȻ�ԽС���ܽ��ԽС���μ����ƣ���Ӧ���������ȳ���������������������CuS��Fe2+��������������ȫʱ��Ũ��Ϊ10��5molL��1 �� ��ʱ��S2����Ũ��Ϊ ![]() mol/L=6.3��10��13mol/L��
mol/L=6.3��10��13mol/L��
���Դ��ǣ�CuS��6.3��10��13mol/L��

 �������ϵ�д�
�������ϵ�д�