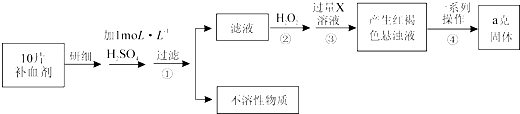
��Ŀ����
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��Ħ���Ρ��Ƿ�����ѧ�е���Ҫ�Լ�����ѧʽΪ(NH4)2Fe(SO4)2��6H2O����Ħ���Ρ���һ�������·ֽ�ķ���ʽΪ��4[(NH4)2Fe(SO4)2��6H2O] ![]() 2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
2Fe2O3��3SO3��5SO2����N2����6NH3����31H2O���ش��������⣺
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ �� ��۲�����Ų�ͼΪ��
��2����ɡ�Ħ���Ρ��ķǽ���Ԫ���е�һ����������Ԫ��Ϊ����Ħ���Ρ��ķֽ���������ڷǼ��Է��ӵĻ���������
��3��NH3�ķе��N2O�ķе�����ߡ��͡���������Ҫԭ������
��4��K3[Fe(CN)6]�����ڼ���Fe2�� �� K3[Fe(CN)6]�г������Ӽ�������ڵĻ�ѧ��Ϊ �� ��CN����Ϊ�ȵ�����ĵ��ʵķ���ʽΪ_��HCN�����ЦҼ��ͦм��ĸ���֮��Ϊ��
��5��FeO�����ṹ����ͼ��ʾ��FeO������Fe2+��λ��Ϊ �� ���þ����߳�Ϊacm����þ����ܶ�Ϊ��
���𰸡�
��1���������ڵڢ��壻![]()
��2��N��SO3
��3���ߣ�NH3���Ӽ�������
��4�����ۼ�����λ����N2��1:1
��5��6��![]() g/cm3
g/cm3
���������⣺��1��)����ԭ��������26��λ�ڵ������ڵڢ���;���ݺ�������Ų����ɿ�֪���ļ۲�����Ų�ͼΪ ![]() ����2����ɡ�Ħ���Ρ��ķǽ���Ԫ����H��N��O��S�����е�һ����������Ԫ��ΪN������������ƽ�������νṹ�����ڷǼ��Է��ӡ���3��NH3���Ӽ������������NH3�ķе��N2O�ķе�ߡ���4��K3[Fe(CN)6]�����У�����Fe3���пչ�����ܽ��ܹ¶Ե��ӣ�CN-���ṩ�¶Ե��ӣ�����Fe3����CN-֮��Ļ�ѧ������Ϊ��λ��������C��N֮�仹�й��ۼ�;�ȵ�������ԭ������ȣ��۵�����Ҳ��ȵ����ӻ���ӣ���CN-��Ϊ�ȵ�����ĵ��ʵķ���ʽΪN2;(5)����������Ϊ���ģ���X��Y��Z��������и��֪����������λ��Ϊ
����2����ɡ�Ħ���Ρ��ķǽ���Ԫ����H��N��O��S�����е�һ����������Ԫ��ΪN������������ƽ�������νṹ�����ڷǼ��Է��ӡ���3��NH3���Ӽ������������NH3�ķе��N2O�ķе�ߡ���4��K3[Fe(CN)6]�����У�����Fe3���пչ�����ܽ��ܹ¶Ե��ӣ�CN-���ṩ�¶Ե��ӣ�����Fe3����CN-֮��Ļ�ѧ������Ϊ��λ��������C��N֮�仹�й��ۼ�;�ȵ�������ԭ������ȣ��۵�����Ҳ��ȵ����ӻ���ӣ���CN-��Ϊ�ȵ�����ĵ��ʵķ���ʽΪN2;(5)����������Ϊ���ģ���X��Y��Z��������и��֪����������λ��Ϊ ![]() =6;��ͼ��֪���þ������������Ӹ���
=6;��ͼ��֪���þ������������Ӹ��� ![]() �������Ӹ���=1+12
�������Ӹ���=1+12 ![]() =4��,�辧���߳�Ϊacm���������Ϊa3cm3,��p=
=4��,�辧���߳�Ϊacm���������Ϊa3cm3,��p= 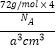 =
= ![]() g/cm3��
g/cm3��