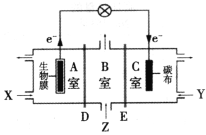
题目内容
【题目】2019年国际非政府组织“全球计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)CO2催化加氢制甲醇的有关反应及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡常数 | ||
500℃ | 700℃ | 800℃ | |
Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) | 1.0 | 1.70 | 2.52 |
Ⅱ.2H2(g)+CO(g) CH3OH(g) | 2.5 | 0.34 | 0.15 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH | |||
①ΔH___0(填“>”、“<”或“=”)。
②已知反应Ⅲ的速率方程式:υ正=k正·c3(H2)·c(CO2),υ逆=k逆·c(CH3OH)·c(H2O),k正、k逆为速率常数。反应达到平衡后,仅升高温度,k正增大的倍数___k逆增大的倍数(填“大于”、“小于”或“等于”)。
③500℃时,向恒容的密闭容器中加入1molCO2和1molH2,控制反应条件只发生反应Ⅰ。达到平衡后,只改变下列条件,能使CO的平衡体积分数增大的是___(填选项字母)。
A.增大压强 B.降低温度 C.再通入等物质的量CO2和H2 D.分离出部分水
(2)在200℃时,向5L带气压计的恒容密闭容器中通入2molCO2和2molCH4发生反应CH4(g)+CO2(g)2H2(g)+2CO(g),测得初始压强为P0kPa,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
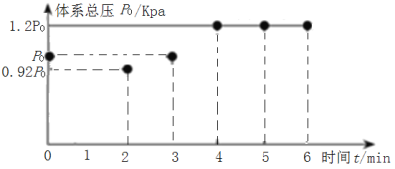
①该反应过程中从0min到2min压强变化原因是___。
②0~4min内,反应的平均反应速率υ(CO2)=___。
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[气体分压(p分)=气体总压(p总)×气体体积分数]
(3)科学家提出利用CO2与CH4制备“合成气”(CO、H2)可能的反应历程如图所示。
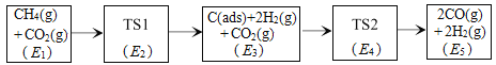
注:C(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量[如第一个方框中1个CH4(g)+1个CO2(g)的相对总能量为E1eV,单位:eV]。其中,TS表示过渡态。
①CH4(g)+CO2(g) 2H2(g)+2CO(g)ΔH=___kJ·mol-1(已知:1eV=1.6×10-22kJ)
②若E4+E1<E3+E2,则决定制备“合成气”反应速率的反应方程式为___。
【答案】< 小于 D 反应为吸热反应,温度降低使体系压强减小 0.02mol·L-1·min-1 0.01P02(kPa)2 96.32(E5-E1)或1.6×10-22NA(E5-E1) CH4(g)=C(ads)+2H2(g)或CH4(g)+CO2(g)=C(ads)+2H2(g)+CO2(g)
【解析】
根据平衡常数表达式和温度对平衡常数的影响判断,根据温度对化学平衡的影响判断反应Ⅲ的移动方向,选择使反应Ⅰ正向移动方向的措施。列出“三段式”计算反应速率和平衡常数。利用盖斯定律计算出焓变的大小。计算出活化能较高的反应是决速反应。
①Ⅰ.H2(g)+CO2(g)H2O(g)+CO(g),K1=![]() ;
;
Ⅱ.2H2(g)+CO(g) CH3OH(g),K2=![]() ;
;
Ⅲ=Ⅰ+Ⅱ,3H2(g)+CO2(g) CH3OH(g)+H2O(g) K3=![]() =K1×K2,根据表中数据依次计算出500℃、700℃、800℃的K3依次为2.5、0.578、0.378,温度越高,K3越小,故ΔH<0;
=K1×K2,根据表中数据依次计算出500℃、700℃、800℃的K3依次为2.5、0.578、0.378,温度越高,K3越小,故ΔH<0;
②已知反应Ⅲ:3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH<0 ,反应达到平衡后,仅升高温度,正逆反应速率都增大,平衡逆向移动,正反应速率增大的倍数比逆反应速率增大的倍数小,υ正=k正·c3(H2)·c(CO2)<υ逆=k逆·c(CH3OH)·c(H2O),即k正增大的倍数小于k逆增大的倍数;
③反应Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) ,升高温度平衡常数增大,则反应I的ΔH>0,
A.增大压强,平衡不移动,CO的平衡体积分数不变,故A不符合题意;
B.降低温度,平衡逆向移动,CO的平衡体积分数减小,故B不符合题意;
C.再通入等物质的量CO2和H2,相当于增大压强,平衡不移动,CO的平衡体积分数不变,故C不符合题意;
D.分离出部分水,平衡正向移动,能使CO的平衡体积分数增大,故D符合题意;
答案选D。
(2)在200℃时,向5L带气压计的恒容密闭容器中通入2molCO2和2molCH4发生反应CH4(g)+CO2(g)2H2(g)+2CO(g),测得初始压强为P0kPa,
①图中可以看出,该反应过程中从0min到2min压强减小,原因是该反应为吸热反应,温度降低使体系压强减小;
②4min后压强不再变化,说明4min时已经达到平衡,设从起始到平衡转化CH4物质的量为xmol,用三段式
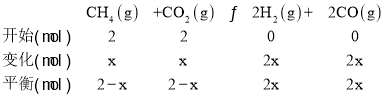
由图中数据可以看出平衡时的总压强为1.2P0kPa,起始总压强为P0kPa,气体的压强之比等于物质的量之比,![]() ,解得x=0.4,平衡时气体的总物质的量等于4mol+2xmol=4mol+2×0.4mol=4.8mol,0~4min内,反应的平均反应速率υ(CO2)=
,解得x=0.4,平衡时气体的总物质的量等于4mol+2xmol=4mol+2×0.4mol=4.8mol,0~4min内,反应的平均反应速率υ(CO2)=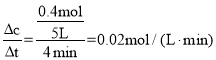 ;
;
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=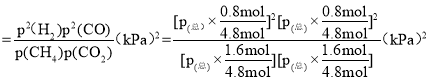
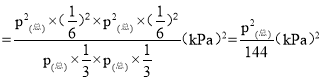 =
=![]() ;
;
(3) ①根据流程图可知,第一步:CH4(g) 2H2(g)+ C(ads) ΔH1= (E3- E1span>)NAeV;
第二步:CO2(g)+C(ads)2CO(g) ΔH2= (E5 - E3) NAeV;
第一步加第二步得到:CH4(g)+CO2(g)2H2(g)+2CO(g)ΔH=(E5-E1) NAeV=1.6×10-22NA (E5-E1) kJ或96.32 (E5-E1) kJ;
②决速步骤,指反应历程中反应速率最慢的反应;速率快慢则由反应的活化能决定,活化能越大,反应速率越慢;若E4+E1<E3+E2,则E2-E1>E4-E3,则决定制备“合成气”反应速率的反应方程式为:CH4(g)=C(ads)+2H2(g)或CH4(g)+CO2(g)=C(ads)+2H2(g)+CO2(g)。

【题目】化合物A、B是中学常见的物质,其阴阳离子可从表中选择.
阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
阴离子 | OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣ |
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:
①A中的化学键类型为_________(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:
①A的化学式为__________________________ .
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ._______________________.Ⅱ._________________________.
③请用一简易方法证明上述溶液变黄的原因_________________________.
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.