题目内容
11.下列有关仪器使用方法或实验操作正确的是( )| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 锥形瓶看用作加热的反应器 | |
| C. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 | |
| D. | 用98%,1.84g/mL的浓硫酸配制1mol/L,500mL的稀硫酸时,应用量简量取浓硫酸约27.17mL |
分析 A.带刻度仪器不能烘干;
B.锥形瓶可用于加热,加热时需要垫上石棉网;
C.俯视刻度线,会导致加入的蒸馏水体积偏小;
D.量筒精确到0.1.
解答 解:A.不能用烘箱烘干带刻度仪器,会造成误差,故A错误;
B.锥形瓶在制取气体的简易装置中经常作反应容器,不过加热时需要垫上石棉网,故B正确;
C.定容时俯视,液面在刻度线下方,溶液的体积偏小,所配溶液浓度偏高,故C错误;
D.量筒精确到0.1,无法量取27.17mL,故D错误.
故选B.
点评 本题考查了化学实验基本操作,包括仪器使用,误差分析等,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.一定温度下,对于两个可逆反应A(g)+2B(g )?2C(g)和A(s)+2B(g)?2C(g),都能说明两个反应都已达到平衡的是( )
| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
19.2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点.当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1:
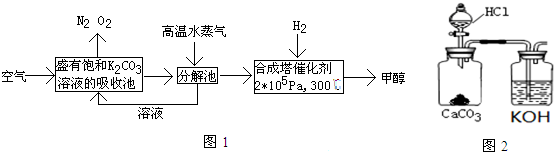
①上述流程中碳酸钾溶液所起的作用是吸收或富集二氧化碳.
②在分解池中发生的反应为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:CO32-+H+═HCO3-;HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是碳酸氢钾氯化钾或氢氧化钾和氯化钾.
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如表数据:
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是2:1;所用硫酸的物质的量浓度为0.75mol•L-1.
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1:

①上述流程中碳酸钾溶液所起的作用是吸收或富集二氧化碳.
②在分解池中发生的反应为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:CO32-+H+═HCO3-;HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是碳酸氢钾氯化钾或氢氧化钾和氯化钾.
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如表数据:
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
19.下列说法正确的是( )
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色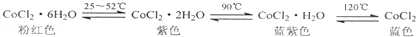 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
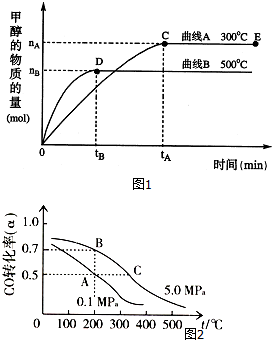 随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);
随着人类对环境和资源短缺等问题的重视,如何降低大气中有害气体的含量及对其有效地开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO来生产燃料甲醇.一定条件下的密闭容器中,CO和H2生成甲醇的反应:CO(g)+2H2(g)?CH3OH(g);