题目内容
19.按要求写出下列化学用语(1)自来水中氯离子检验的离子方程式Ag++Cl-=AgCl↓
(2)盐酸除铁锈的离子方程式6H++Fe2O3=2Fe3++3H2O
(3)二氧化碳通入澄清石灰水的离子方程式CO2+Ca2++2OH-=CaCO3↓+H2O.
分析 (1)利用硝酸银检验氯离子;
(2)盐酸与氧化铁反应生成氯化铁和水;
(3)二氧化碳与石灰水反应生成碳酸钙、水.
解答 解:(1)利用硝酸银检验氯离子,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(2)盐酸与氧化铁反应生成氯化铁和水,离子反应为6H++Fe2O3=2Fe3++3H2O,故答案为:6H++Fe2O3=2Fe3++3H2O;
(3)二氧化碳与石灰水反应生成碳酸钙、水,离子反应为CO2+Ca2++2OH-=CaCO3↓+H2O,故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应方程式书写的方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
10.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图所示装置(图A中的加热装置没有画出)制取高纯度的苯甲酸甲酯,实验前他们从有关化学手册中查得相关物质的物理性质如表所示:
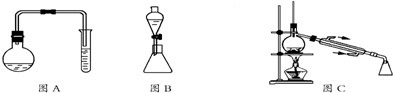
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式为 .
.
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式为
 .
.实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
7.下列物质分类正确的是( )
| A. | 稀豆浆、雾、淀粉溶液、硫酸铜溶液均为胶体,也为混合物 | |
| B. | SO2、H2O、CO、CO2均为酸性氧化物,也为非金属氧化物 | |
| C. | 干冰、氨气、冰水混合物均为纯净物,也为化合物 | |
| D. | 凡是溶于水后能电离出H+的化合物就叫酸 |
14.不能用离子方程式2H++CO32-=H2O+CO2↑表示的化学方程式是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||
| C. | K2CO3+2HCl═2KCl+H2O+CO2↑ | D. | Na2CO3+2HNO3═2NaNO3+H2O+CO2↑ |
11.下列离子方程式的书写中,正确的是( )
| A. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| C. | 过量二氧化碳跟苛性钾反应:CO2+2OH-=CO32-+H2O | |
| D. | 硫酸氢钾和氢氧化钡按等物质的量在溶液中反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
9.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值增大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10 mL pH=11的NaOH溶液,酸与碱恰好完全反应 |