题目内容
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
(1)用“>”、“=”或“<”填空:该反应的ΔH______0,m+n______p。
(2)用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入B,则A的转化率________;升高温度,则平衡时B、C的浓度之比c(B)/c(C)将________;加入催化剂,平衡时气体混合物的总物质的量________。
(3)若A、C均为无色气体,B为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入C,平衡混合物的颜色________;而恒压充入氖气,平衡混合物颜色________。
【答案】 > > 增大 减小 不变 变深 变浅
【解析】mA(g)+nB(g)pC(g)达到平衡后,当升高温度时,B的转化率变大,说明温度升高,平衡向正反应方向移动,则正反应吸热,当减小压强时,混合体系中C的质量分数也减小,说明压强减小,平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,根据外界条件对化学平衡的影响解答该题。
(1)升高温度时,B的转化率变大,则升高温度平衡正向移动,该反应为吸热反应;减小压强时,混合体系中C的质量分数也减小,则减小压强平衡逆向移动,则m+n>p,故答案为:>;>;
(2)恒容下,在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大;正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以c(B)/c(C)将减小;催化剂对化学平衡移动没有影响,所以加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:增大;减小;不变;
(3)若A、C均为无色气体,B为红色气体,则恒容下加入C平衡向逆反应方向移动,B的浓度增大,则混合物的颜色加深,而维持容器内压强不变,充入氖气时,体积增大,B的浓度减小,颜色变浅,故答案为:变深;变浅。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】碘及其化合物在生产、生活中具有重要作用。请按要求回答下列问题:
(1)海带灰浸取液中的碘元素以I-形式存在。现利用如下试剂:MnO2、稀硫酸、淀粉溶液,从中获取单质碘。请按要求完善下表:
序号 | 所选试剂 | 反应原理或现象或解释 |
方法1 | MnO2、稀硫酸 | 离子方程式:________ |
方法2 | 稀硫酸、淀粉溶液 | 溶液变蓝的原因。用离子方程式解释: ____________ |
(2)反应2HI(g) ![]() H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
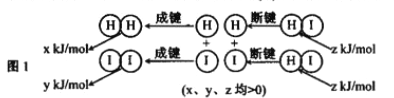

①比较2z______(x+y)(填 “<"、“>”或“=”).
②某温度下该反应的平衡常数K=1/9,达平衡时,HI的转化率=___________。
③只改变该反应的一个条件,试写出能提高HI转化率的两项措施:__________、_________。
(3)已知:i.分解1molH2O2放出热量98kJ;ⅱ.含少量I-的溶液中,H2O2的分解机为: H2O2+I-![]() H2O+IO-慢;H2O2+IO-
H2O+IO-慢;H2O2+IO-![]() H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
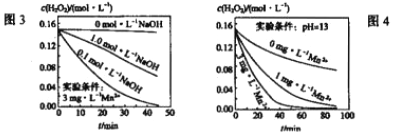
请完善由以上信息可得到的如下结论:
①H2O2分解反应的热化学方程式为___________。
②H2O2的分解速率与_________有关。
③“少量Mn2+存在时,溶液碱性越强H2O2分解速率越大”的结论是否正确_______(填“是"或“否”);c(Mn2+)对H2O分解速率的影响是__________。


