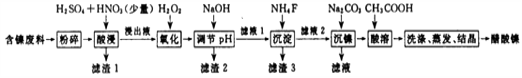
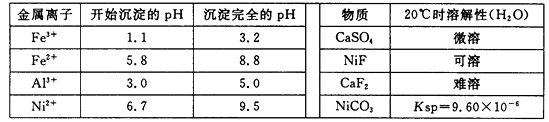
题目内容
【题目】浓硫酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
①氧化剂是H3AsO3;②还原性:Cl->As;
③每生成7.5gAs,还原剂失去的电子为0.3 mol;
④M为OH-;⑤ SnCl62-是氧化产物。
关于该反应的说法中正确的组合是( )
A.①③⑤
B.①③
C.①②④⑤
D.①②③④
【答案】A
【解析】①As元素的化合价降低,氧化剂为H3AsO3 , 故①正确;②Cl元素的化合价在该反应中不变,则不能比较Cl-、As的还原性,故②错误;③As元素由+3价降低为0,则每生成7.5g As,还原剂失去的电子为 ![]() ×(3-0)=0.3mol,故③正确;④由原子守恒可知,M为H2O,故④错误;⑤因Sn元素的化合价升高,则SnCl62-为氧化产物,故正⑤确;
×(3-0)=0.3mol,故③正确;④由原子守恒可知,M为H2O,故④错误;⑤因Sn元素的化合价升高,则SnCl62-为氧化产物,故正⑤确;
故选A。根据方程式中元素化合价变化判断氧化剂和还原剂、氧化产物和还原产物,以及电子转移数值和还原性强弱即可。

练习册系列答案
相关题目