题目内容
19.下列解释实验事实的方程式不正确的是( )| A. | 工业上用氧化铝冶炼金属铝:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 工业上用过量的NaOH溶液吸收SO2:SO2+OH-=HSO${\;}_{3}^{-}$ | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO${\;}_{2}^{-}$+H2O | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
分析 A.电解熔融氧化铝可以生成铝和氧气;
B.氢氧化钠过量,反应生成亚硫酸根离子和水;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
D.二氧化硫与氧气、碳酸钙反应生成硫酸钙和二氧化碳,达到吸收二氧化硫的目的.
解答 解:A.工业上用氧化铝冶炼金属铝的反应为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故A正确;
B.工业上用过量的NaOH溶液吸收SO2,反应生成亚硫酸钠和水,正确的离子方程式为:SO2+2OH-=H2O+SO32-,故B错误;
C.用烧碱溶液清洗铝表面的氧化膜,氧化膜的充分为氧化铝,反应的离子方程式为:2OH-+Al2O3=2AlO2-+H2O,故C正确;
D.煤中加入石灰石可减少煤燃烧时SO2的排放,反应的化学方程式为:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2,故D正确;
故选B.
点评 本题考查离子反应方程式、化学方程式的书写判断,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
9.下列说法错误的是( )
| A. | 按系统命名法,化合物  的名称为2,3-二甲基丁烷 的名称为2,3-二甲基丁烷 | |
| B. | 等质量的甲醛、乙酸、葡萄糖完全燃烧耗氧量相等 | |
| C. | 在一定条件下,使煤和氢气作用,可以得到液体燃料 | |
| D. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 |
10.下列装置所示的实验中,能够达到实验目的是( )
| A. |  用铜和稀硝酸制取NO | B. |  分离乙醇和乙酸 | ||
| C. | 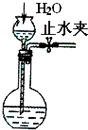 检查装置气密性 | D. | 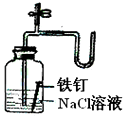 证明铁生锈空气参与反应 |
7.下列与金属腐蚀有关的说法正确的是( )
| A. | 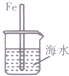 图中,插人海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 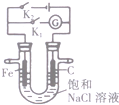 图中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 | |
| C. | 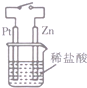 图中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 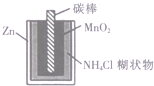 图中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
14.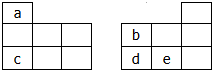 如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.
如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.
 如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.
如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.| A. | 原子半径:b>c | |
| B. | 由a、b、e三种元素形成的化合物可能是离子化合物 | |
| C. | c与e以原子个数比2:1形成的化合物能促进水的电离 | |
| D. | 氢化物的稳定性:b<d. |
2.下列说法正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
6.下列有机物中,可能使酸性高锰酸钾溶液褪色的是( )
| A. | CH4 | B. | C2H4O2 | C. | 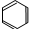 | D. | C8H18 |
7.下列离子方程式正确的是( )
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向明矾溶液中加过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
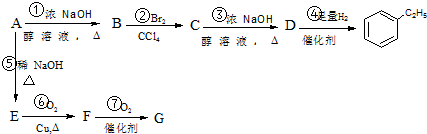
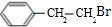 ; B
; B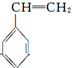 ; D
; D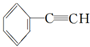 ;G
;G .
.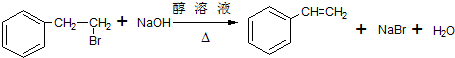 ;
; .
.