题目内容
14.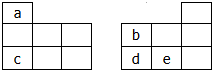 如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.
如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是(0.| A. | 原子半径:b>c | |
| B. | 由a、b、e三种元素形成的化合物可能是离子化合物 | |
| C. | c与e以原子个数比2:1形成的化合物能促进水的电离 | |
| D. | 氢化物的稳定性:b<d. |
分析 b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,则b为N元素,由元素在短周期中的位置可知,a为H元素、c为Na、d为P、e为S.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
B.由a、b、e三种元素形成的化合物可以为(NH4)2S、NH4HS等;
C.c与e以原子个数比2:1形成的化合物为Na2S,溶液中硫离子发生水解;
D.同主族自上而下,元素非金属性减弱,氢化物稳定性减弱.
解答 解:b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,则b为N元素,由元素在短周期中的位置可知,a为H元素、c为Na、d为P、e为S.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:c>b,故A错误;
B.由a、b、e三种元素形成的化合物可以为(NH4)2S、NH4HS等,二者均属于离子化合物,故B正确;
C.c与e以原子个数比2:1形成的化合物为Na2S,溶液中硫离子发生水解,促进水的电离,故C正确;
D.同主族自上而下,元素非金属性减弱,氢化物稳定性减弱,故D错误,
故选BC.
点评 本题考查结构性质位置关系应用,注意掌握元素周期表结构,有利于基础知识的巩固,难度不大.

练习册系列答案
相关题目
4.下列除杂操作可行的是( )
| A. | 通过浓硫酸除去HCl中的H2O | |
| B. | 通过灼热的镁粉除去N2中的O2 | |
| C. | 制二氧化氮时,用水或NaOH溶液吸收尾气 | |
| D. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 |
5.关于下列各实验装置的叙述中,不正确的是( )
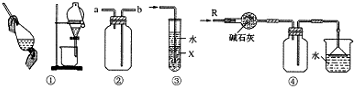

| A. | 装置①可用于分离苯和水的化合物 | |
| B. | 装置②可用于排气法收集H2、CO2、Cl2、NO、NO2等气体 | |
| C. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
2.解释下列事实的方程式正确的是( )
| A. | 加热可增强纯碱溶液去污能力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+2CaSO4 | |
| D. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ |
19.下列解释实验事实的方程式不正确的是( )
| A. | 工业上用氧化铝冶炼金属铝:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | |
| B. | 工业上用过量的NaOH溶液吸收SO2:SO2+OH-=HSO${\;}_{3}^{-}$ | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO${\;}_{2}^{-}$+H2O | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
1.下列属于原子晶体的是( )
| A. | 干冰 | B. | 石英 | C. | 食盐 | D. | 冰 |
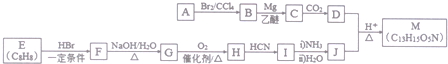
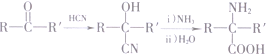 (R′表示氢原子或烃基)
(R′表示氢原子或烃基)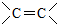 ,
,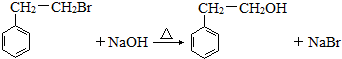 .
.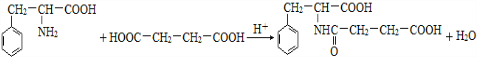 .
.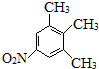 、
、 (不考虑立体异构).
(不考虑立体异构).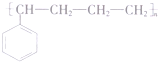 的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.
的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3. .其合成路线如图.
.其合成路线如图.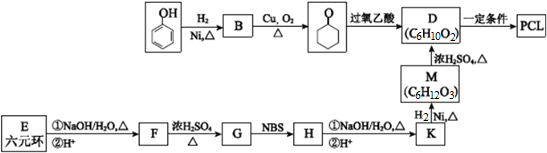
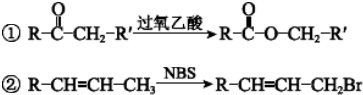
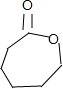 .
. .
.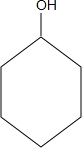 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$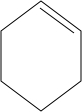 $→_{Zn/H_{2}O}^{O_{3}}$OHCCH2CH2CH2CH2CHO$\stackrel{O_{2}}{→}$HOOCCH2CH2CH2CH2COOH.
$→_{Zn/H_{2}O}^{O_{3}}$OHCCH2CH2CH2CH2CHO$\stackrel{O_{2}}{→}$HOOCCH2CH2CH2CH2COOH.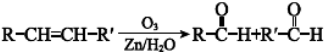
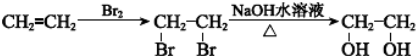
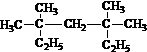 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
; ;
; .
.