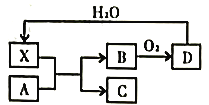
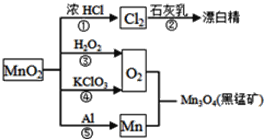
题目内容
【题目】下表列出了①~⑨九种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ⑧ |
请按要求回答下列问题:
(1)元素④的名称是________,元素④在周期表中所处位置________,从元素原子得失电子的角度看,元素④形成的单质具有________性(填“氧化性”或“还原性”)。
(2)元素⑦的原子结构示意图是________。
(3)按气态氢化物的稳定性由弱到强的顺序排列,④⑦⑨的氢化物稳定性:_____________________(写氢化物的化学式)。
(4)写出元素⑤形成的单质与水反应的化学方程式____________________。
(5)①与⑨能形成一种化合物,用电子式表示该化合物的形成过程_____________________。
(6)工业制取⑥的单质的反应的化学方程式为_____________________。
【答案】氧 第二周期第ⅥA族 氧化 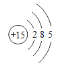 PH3<H2S<H2O 2Na+2H2O==2NaOH+H2↑
PH3<H2S<H2O 2Na+2H2O==2NaOH+H2↑ ![]() 2Al2O3 (熔融)
2Al2O3 (熔融) 4Al + 3O2↑
4Al + 3O2↑
【解析】
根据元素在周期表中的相对位置可知①~⑨九种元素分别是H、C、N、O、Na、Al、P、Cl、S,结合元素周期律和相关物质的性质分析解答。
(1)元素④是O,名称是氧,在周期表中所处位置是第二周期第ⅥA族。氧元素最外层电子数是6个,容易得到电子达到8电子稳定结构,因此从元素原子得失电子的角度看,元素④形成的单质具有氧化性;
(2)元素⑦是P,原子序数是15,其原子结构示意图是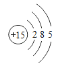 ;
;
(3)非金属性是O>S>P,非金属性越强,氢化物越稳定,则按氢化物的稳定性由弱到强的顺序排列,④⑦⑨的氢化物稳定性为PH3<H2S<H2O;
(4)元素⑤形成的单质钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(5)①与⑨能形成一种化合物是共价化合物H2S,用电子式表示该化合物的形成过程为![]() ;
;
(6)铝是活泼的金属,工业制取⑥的单质需要电解法,反应的化学方程式为2Al2O3(熔融) 4Al+3O2↑。
4Al+3O2↑。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W | X | |
Z |
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:![]()