题目内容
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
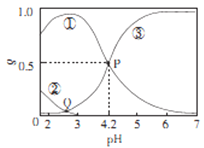
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
【答案】B
【解析】A.根据图像,随着pH的增大,溶液的酸性减弱,③的分布分数δ增大,说明③表示C2O42-的分布曲线,①的分布分数δ减小,②在pH>3的溶液中几乎不存在,说明②是H2C2O4的分布曲线,则①表示HC2O4-的分布曲线,故A错误;B.P点c(HC2O4-)=c(C2O42-),该温度下H2C2O4的电离平衡常数Ka2=![]() =c(H+)=1×10-4.2molL-1 ,故B正确;C. Q点对应溶液的pH在2~3之间,说明c(H+)在10-3 mol/L ~10-2 mol/L之间,则c(OH-)在10-12 mol/L ~10-11 mol/L之间,则lgc(H+)>1gc(OH-),故C错误;D.0.100molL-1的NaHC2O4溶液中存在物料守恒,c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-),电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(OH-)+c(HC2O4-),计算得到c(OH-)+c(C2O42-)═c(H+)+c(H2C2O4),即c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4),故D错误;故选B。
=c(H+)=1×10-4.2molL-1 ,故B正确;C. Q点对应溶液的pH在2~3之间,说明c(H+)在10-3 mol/L ~10-2 mol/L之间,则c(OH-)在10-12 mol/L ~10-11 mol/L之间,则lgc(H+)>1gc(OH-),故C错误;D.0.100molL-1的NaHC2O4溶液中存在物料守恒,c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-),电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(OH-)+c(HC2O4-),计算得到c(OH-)+c(C2O42-)═c(H+)+c(H2C2O4),即c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4),故D错误;故选B。

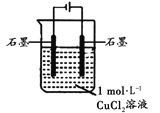
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
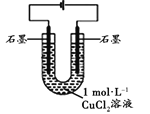
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A | B | C | D | |
中华 文化 | “千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》 | 《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。” | 成语“刀耕火耨(nòu)” |
侯德榜 |
从化学 的视角 理解 | 诗句中的“淘、漉”相当于分离提纯操作中的“过滤” | “钳”是指作为熔铁炉、加热炉的坩埚 | 古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱 |
A. A B. B C. C D. D