题目内容
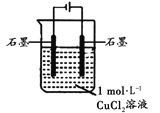
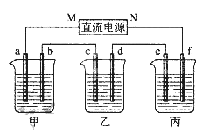
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
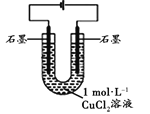
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
【答案】 Cl2 电解过程放热导致温度升高,Cu2+ + 4Cl-![]() [CuCl4]2-正向移动 阳极附近溶液仍为蓝色 U型管冷却后阴极附近溶液仍为绿色 证明在上述实验条件下,电解后的绿色溶液中存在[CuCl2]- Cu2+ + 4Cl-+ Cu
[CuCl4]2-正向移动 阳极附近溶液仍为蓝色 U型管冷却后阴极附近溶液仍为绿色 证明在上述实验条件下,电解后的绿色溶液中存在[CuCl2]- Cu2+ + 4Cl-+ Cu ![]() 2[CuCl2]- 加入CuCl2蓝色溶液,直至溶液颜色与电解后绿色溶液基本相同
2[CuCl2]- 加入CuCl2蓝色溶液,直至溶液颜色与电解后绿色溶液基本相同
【解析】(1) 用石墨作阴阳极,电解CuCl2溶液,阳极石墨上析出氯气,氯气呈黄绿色,能溶于水,使水溶液呈绿色。正确答案为氯气(或Cl2)。
(2)在CuCl2溶液中存在平衡:Cu2+ + 4Cl— ![]() [CuCl4]2— (黄色) ΔH>0,根据实验现象,电解后烧杯壁变热,说明温度升高了,使该平衡向正反应方向移动,使[CuCl4]2—浓度增大。
[CuCl4]2— (黄色) ΔH>0,根据实验现象,电解后烧杯壁变热,说明温度升高了,使该平衡向正反应方向移动,使[CuCl4]2—浓度增大。
(3)丙的实验证明电解后在阳极上仍有氯气产生,但阳极附近的溶液没有变绿色,仍是蓝色,所以否定了甲;而阴极上有红色物质析出,溶液由蓝色变绿色,U型管变热,这些现象与乙的相同,但是冷却后溶液仍为绿色,可见,温度的改变并没有改变溶液的颜色,也就是说上述平衡没有受温度的改变而移动,所以否定了乙。
(4) ①根据资料“ii :稀释含[CuCl2]—的溶液生成CuCl白色沉淀”。所以a操作的目的就是证明上述实验,电解后的绿色溶液中含[CuCl2]-;② 根据b叙述中涉及到的物质,即可写出反应的离子方程式为Cu2+ + 4Cl-+ Cu![]() 2[CuCl2]- 。③根据资料“i:[CuCl2]—掺杂Cu2+后才呈黄色”,所以c的操作就是加入CuCl2溶液,直至溶液也呈绿色,再重复操作a,有白色沉淀生成,证明绿色溶液中确实含有[CuCl2]—。
2[CuCl2]- 。③根据资料“i:[CuCl2]—掺杂Cu2+后才呈黄色”,所以c的操作就是加入CuCl2溶液,直至溶液也呈绿色,再重复操作a,有白色沉淀生成,证明绿色溶液中确实含有[CuCl2]—。