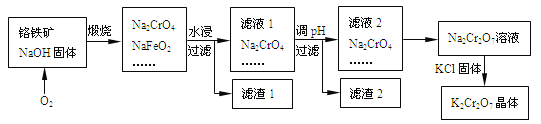
题目内容
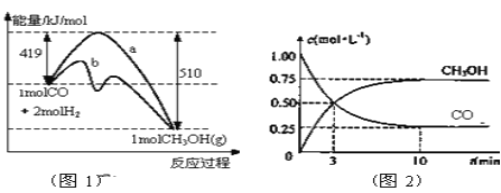
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题
(1)在“图1”中,曲线______(填a或b)表示使用了催化剂;该反应属于_____________(填吸热、放热)反应。
(2)从反应开始到建立平衡, v(H2)=________;反应达到化学平衡时,下列有关叙述正确的是______ 。
a.容器内气体压强保持不变
b.反应放热182 kJ
c.若升温,该反应的v(正)增大,v(逆)减小
d.若向容器内通入少量氢气,则此时v(正)>v(逆)
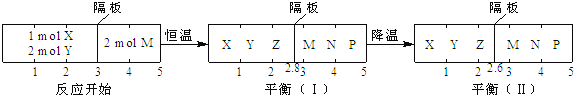
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l)+ 3O2(g)==2CO2(g)+4 H2O(l)。其工作原理示意图如下:
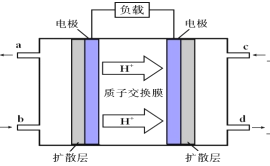
①上图的出入口通入或排出的物质名称(或化学式)b________ ,a_____________.
②负极的电极反应式为_____________________________________。电池中放电过程中负极附近溶液的pH将_____________(填“下降”、“上升”或“不变”);
(4)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式___________________________。该电池的负极反应式__________________________________。放电时固体电解质里的O2-离子的移动方向是向_________________极移动(填“正”或“负”)。
【答案】 b 放热 0.15 mol/L.min-1 ad CH3OH CO2 CH3OH-6e-+H2O=CO2+6H+ 下降 O2+4e-=2O2- C4H10-26e-+13O2-=4CO2+5H2O 负
【解析】(1)催化剂降低反应的活化能,则在“图1”中,曲线b表示使用了催化剂;反应物总能量高于生成物总能量,该反应属于放热反应。(2)从反应开始到建立平衡,生成甲醇是0.75mol/L,根据方程式可知消耗氢气是1.5mol/L,则v(H2)=1.5mol/L÷10min=0.15 mol/L·min-1;a.正反应体积减小,反应达到化学平衡时,容器内气体压强保持不变,a正确;b.生成甲醇是0.75mol/L,物质的量是1.5mol,所以反应放热1.5×(510kJ-419kJ)=136.5kJ,b错误;c.若升温,正逆反应速率均增大,c错误;d.若向容器内通入少量氢气,反应物浓度增大,平衡向正反应方向进行,则此时v(正)>v(逆),d正确,答案选ad;
(3)①原电池中阳离子向正极移动,则根据图中氢离子的移动方向可知右侧电极是正极,左侧是负极,因此b处通入的是甲醇,甲醇的氧化产物是CO2,则a处流出的是CO2;②甲醇在负极通入,负极的电极反应式为 CH3OH-6e-+H2O=CO2+6H+。根据负极电极反应式可知负极产生氢离子,则电池中放电过程中负极附近溶液的pH将下降;(4)氧气在正极通入,由于传递的是氧离子,则该电池的正极反应式为O2+4e-=2O2-。汽油在负极通入,该电池的负极反应式为C4H10-26e-+13O2-=4CO2+5H2O。原电池中阴离子向负极移动,则放电时固体电解质里的O2-离子的移动方向是向负极移动。