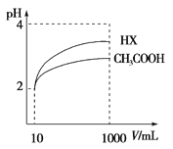
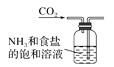
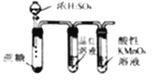
题目内容
【题目】以铬铁矿为原料制备铬酸钾(K2Cr2O7)的工艺流程如下图所示。铬铁矿的主要成分可表示为FeO-Cr2O3和杂质SiO2。
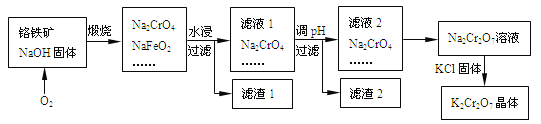
已知:①NaFeO2遇水强烈水解
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
回答下列问题:
(1)K2CrO4中Cr元素的化合价是________。
(2)完成并配平煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式________
FeO-Cr2O3+ O2+ NaOH![]() Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
该反应的氧化产物是________。
(3)生成滤渣1中红褐色物质的化学反应方程式是____________。滤渣2的成分(填化学式)_______。
(4)滤液2存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
(5)含铬废水中含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。还原沉淀法是常用的一种方法:
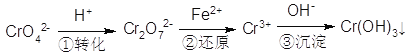
①上述流程中还原过程的离子反应方程式为:_______________。
②最终生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
【答案】 +6 4FeO·Cr2O3+7O2+20NaOH=8Na2CrO4+4NaFeO2+10H2O Na2CrO4 NaFeO2 NaFeO2+2H2O=Fe(OH)3↓+NaOH H2SiO3 (或H4SiO4) B、C Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 没有
【解析】试题分析:试题以铬酸钾制备和含铬废水的处理为题材,考查元素化合价、氧化产物、氧化还原反应配平、离子方程式、化学平衡的移动、沉淀溶解平衡的计算等知识。考查考生对工业流程的分析能力和对知识的综合运用能力。
解析:在O2作用下,铬铁矿与NaOH固体煅烧时,除生成Na2CrO4和NaFeO2之外,SiO2也同时反应生成Na2SiO3;水浸时,Na2CrO4、Na2SiO3溶解,NaFeO2水解,滤液1调节pH值后过滤出含Si化合物等杂质得到Na2Cr2O7溶液。
(1)K为+1价,O为-2价,所以Cr为+6价。答案:+6。(2)反应物FeO—Cr2O3中Fe从+2价升高到+3价、Cr从+3价升高到+6价升高3价,共升高7价,生成的Na2CrO4、 NaFeO2是该反应的氧化产物; O2中O从0价降低到-2价降低2价,共降低4价,根据得失电子守恒,参加反应的FeO—Cr2O3化学计量系数为4,O2的化学计量系数为7,即4FeO·Cr2O3+7O2+NaOH→Na2CrO4+NaFeO2+H2O ,再用原子守恒配平其他系数。答案:4FeO·Cr2O3+7O2+20NaOH=8Na2CrO4+4NaFeO2+10H2O、Na2CrO4 NaFeO2 。(3)滤渣1是水浸时NaFeO2水解生成的不溶物,根据“红褐色”提示,应当是Fe(OH)3;滤渣2是在调节pH时除去Na2SiO3产生的沉淀,只能是H2SiO3或H4SiO4。答案:Fe(OH)3、H2SiO3或H4SiO4。(4)原平衡正向移动可能是增加反应物浓度或降低生成物浓度、或保持温度不变除去部分水、或改变温度。A、若仅增加CrO42-浓度,平衡移动消耗H+,溶液pH增大;若仅增加H+浓度,达到新的平衡时溶液中c(H+)增大,pH减小;若减小产物浓度,平衡移动消耗H+,溶液pH增大;保持温度不变除去部分水平衡正向移动,但是c(H+)增大,pH减小。综上所述,平衡正向移动时,溶液pH不一定增大,A错误。B、达到新的平衡前,反应始终向正反应方向进行,所以正反应速率一定大于逆反应速率,B正确。C、平衡常数只受温度影响,所以如果不是温度导致题目要求的平衡移动,则平衡常数不变,C正确。D、达到平衡时,v(CrO42-)消耗=v(CrO42-)生成,又因为v(CrO42-)生成/2= v(Cr2O72-)消耗,所以v(CrO42-)消耗/2= v(Cr2O72-)消耗,D错误。正确答案:BC。(5)①还原过程中Cr2O72-生成Cr3+,则反应基础关系为Cr2O72-+Fe2+→Cr3++Fe3+,考虑到溶液呈酸性,配平的反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ,答案:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。②当溶液pH=4时,c(OH-)=10-14/10-4mol/L=1×10-10mol/L,QC=1×10-3×(1×10-10)3=1×10-33<1×10-32,此时没有沉淀生成。答案:没有。

 应用题作业本系列答案
应用题作业本系列答案【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
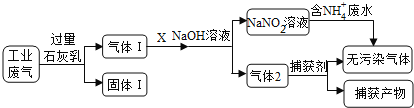
(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。