题目内容
【题目】已知X、Y、Z、W 4种元素分别是元素周期表中3个连续短周期的元素且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)写出Z在周期表中的位置______________。W离子的结构示意图:_______________________。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的结构式为:__________________。
既含离子键又含非极性共价键的化合物的电子式为________;既含极性共价键又含非极性共价键的化合物的电子式为________。
(3)Z的氢化物熔沸点在其同主族氢化物中熔沸点最高,原因是_______________________。
(4)用化学方程式表示Z与其同主族短周期元素的非金属性强弱___________________________ 。
(5)由X、Y、Z所形成的常见离子化合物是________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为____________________;X与W形成的化合物与水反应时,水作________ (填“氧化剂”或“还原剂”)。
【答案】 第二周期 <span style="background-color: rgb(245, 245, 245);">Ⅵ</span>A 族 略 略 略 略 水分子间有氢键 O2 + H2S ==S↓+ 2H2O NH4NO3 NH4+ + OH-== NH3↑+H2O 氧化剂
【解析】Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,且原子序数Y小于Z(O),则Y为N元素;Y与X形成的分子中有3个共价键,且X、Y、Z、W四种元素分别是元素周期表中连续3个短周期的元素可知X为H元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,则(1)Z为O元素,位于周期表的第二周期ⅥA族;钠离子的结构示意图为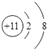 ;(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物为氨气,氨气中含有3个N-H键,氨气的结构式为
;(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物为氨气,氨气中含有3个N-H键,氨气的结构式为![]() ;含有离子键的化合物为离子化合物,且含有非极性共价键的化合物为过氧化钠,过氧化钠的电子式为
;含有离子键的化合物为离子化合物,且含有非极性共价键的化合物为过氧化钠,过氧化钠的电子式为![]() ;既含极性共价键又含非极性共价键的化合物是双氧水,电子式为
;既含极性共价键又含非极性共价键的化合物是双氧水,电子式为![]() ;(3)水分子间形成氢键,所以氧元素的氢化物熔沸点在其同主族氢化物中熔沸点最高;(4)氧气能氧化H2S生成单质S,说明氧元素非金属性强于S,方程式为O2 + H2S ==S↓+ 2H2O;(5)由H、N、O所形成的常见离子化合物为NH4NO3,W的最高氧化物的水化物为NaOH,二者加热反应的离子方程式为:NH4+ + OH-
;(3)水分子间形成氢键,所以氧元素的氢化物熔沸点在其同主族氢化物中熔沸点最高;(4)氧气能氧化H2S生成单质S,说明氧元素非金属性强于S,方程式为O2 + H2S ==S↓+ 2H2O;(5)由H、N、O所形成的常见离子化合物为NH4NO3,W的最高氧化物的水化物为NaOH,二者加热反应的离子方程式为:NH4+ + OH-![]() NH3↑+H2O;X与W形成的化合物为NaH,NaH和水反应生成氢氧化钠和氢气,该反应中NaH中的H有-1价变为0价,化合价升高被氧化,作还原剂。
NH3↑+H2O;X与W形成的化合物为NaH,NaH和水反应生成氢氧化钠和氢气,该反应中NaH中的H有-1价变为0价,化合价升高被氧化,作还原剂。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案