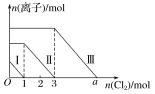
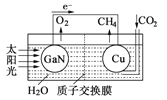
题目内容
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:

请回答下列问题:
(1)仪器c的名称是_______________;
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为________________________________;
(3)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是_______________________;
(4)若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(5)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________________________________________。
【答案】球形冷凝管 4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O 饱和食盐水 0.500或50.0% 取少量W溶液于试管中,加入过量硝酸钡溶液,静置,取上层清液,滴加硝酸酸化的硝酸银,产生白色沉淀,则说明存在Cl-
Mn2++Cl2↑+2H2O 饱和食盐水 0.500或50.0% 取少量W溶液于试管中,加入过量硝酸钡溶液,静置,取上层清液,滴加硝酸酸化的硝酸银,产生白色沉淀,则说明存在Cl-
【解析】
(1)根据仪器的构造求解;
(2)实验室用二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水;
(3)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl;
(4)根据反应SO2+Cl2+SCl2═2SOCl2计算;
(5)SOCl2中加入足量NaOH溶液后溶液中含有亚硫酸根离子,为排除亚硫酸根离子对氯离子的干扰,应先加入硝酸钡将亚硫酸根离子转化为亚硫酸钡而除去。
(1)根据仪器的构造可知,仪器c是球形冷凝管;
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl,按氯气的流向,应先经过饱和的食盐水除去其中的HCl,然后经过浓硫酸洗气除去水蒸气,故答案为:饱和食盐水;
(4)消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为
=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为![]() ×100%=50%;
×100%=50%;
(5)SOCl2中加入足量NaOH溶液后溶液中含有亚硫酸根离子,为排除亚硫酸根离子对氯离子的干扰,应先加入硝酸钡将亚硫酸根离子转化为亚硫酸钡而除去,故答案为:取少量W溶液于试管中,加入过量硝酸钡溶液,静置,取上层清液,滴加硝酸酸化的硝酸银,产生白色沉淀,则说明有Cl-。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()