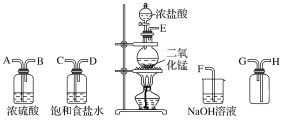
题目内容
【题目】I 金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
① Ti2+基态电子排布式可表示为_______。
② 与BH4-互为等电子体的阳离子的化学式为_______。
(2) 二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如下图所示。
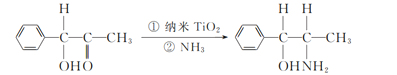
甲 乙
化合物乙的分子中采取sp3杂化方式的原子个数为_______。
(3) 水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1 mol [Ti(OH)2(H2O)4]2+中σ键的数目为_____。
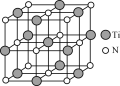
(4) 氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
II Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu基态核外电子排布式为_____。
(2)SO42-的空间构型为_____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为_____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_____;推测抗坏血酸在水中的溶解性:_____(填“难溶于水”或“易溶于水”)。

图1 图2
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_____。
【答案】1s22s22p63s23p63d2或[Ar]3d2 NH4+ 5 16NA Ti4CN3 [Ar]3d104s1 正四面体 O sp3、sp2 易溶于水 4
【解析】
I(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2或[Ar]3d2;
② 原子总数相等,价电子总和相等的微粒互称为等电子体,因此,与BH4-互为等电子体的阳离子的化学式为NH4+;
(2)化合物乙中苯环上6个碳原子均采取sp2杂化方式,一个O原子形成2个σ键还有2对孤对电子为sp3杂化、一个N原子形成3个σ键还有1对孤对电子为sp3杂化,除苯环外的3个碳原子均形成4个σ键为sp3杂化,故化合物乙的分子中采取sp3杂化方式的原子个数为5;
(3)单键全是σ键,1 mol [Ti(OH)2(H2O)4]2+中含有6mol配位键,1molOH-中含1molσ键,1molH2O中含2molσ键,因此σ键物质的量为6mol+2×1mol+4×2mol=16mol,数目为16NA;
(3)晶胞中Ti个数为![]() ,N原子个数为
,N原子个数为![]() ,用碳原子取代氮化钛晶胞顶点的氮原子后C原子位于顶点,个数为1,则N原子数为3,所以晶胞化学式为Ti4CN3;
,用碳原子取代氮化钛晶胞顶点的氮原子后C原子位于顶点,个数为1,则N原子数为3,所以晶胞化学式为Ti4CN3;
II (1)Cu位于第四周期IB族,其价电子排布式为3d104s1,因此基态Cu核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;
(2)SO42-中S形成4个σ键,孤电子对数为(6+2-4×2)/2=0,因此SO42-空间构型为正四面体形;[Cu(OH)4]2-中Cu2+提供空轨道,OH-提供孤电子对,OH-只有O有孤电子对,因此[Cu(OH)4]2-中的配位原子为O;
(3)根据抗坏血酸的分子结构,该结构中有两种碳原子,全形成单键的碳原子和双键的碳原子,全形成单键的碳原子为sp3杂化,双键的碳原子为sp2杂化;根据抗环血酸分子结构,分子中含有4个-OH,能与水形成分子间氢键,因此抗坏血酸易溶于水;
(4)白球位于顶点和内部,属于该晶胞的个数为8×1/8+1=2,黑球全部位于晶胞内部,属于该晶胞的个数为4,化学式为Cu2O,因此白球为O原子,黑球为Cu原子,即Cu原子的数目为4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案