题目内容
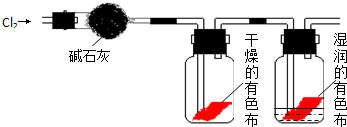
7.某研究性学习小组设计了一组实验来探究元素周期律,利用下图装置可验证元素非金属性的变化规律.
(1)仪器A的名称为分液漏斗,干燥管D的作用为防倒吸.
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加硫化钠(填一种盐的名称)溶液,观察到C中溶液的现象为有淡黄色沉淀生成即可证明.反应的离子方程式为S2-+Cl2=S↓+2Cl-.从环境保护的观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气.
(3)N、C、Si的非金属性由强到弱的顺序是:N>C>Si;从以下所给物质中选出设计该实验所用到物质:仪器A、B、C中的试剂分别为①③④(填序号).
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
但老师认为根据仪器C中的现象也不能从严格意义上证明C(碳)和Si的非金属性的强弱,试分析可能的原因是硝酸有挥发性,随二氧化碳一起逸出.
分析 (1)A的名称是分液漏斗;缓冲装置能防止倒吸;
(2)元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气有毒,不能直接排空,可以用碱液吸收防止污染大气;
(3)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱;强酸能和弱酸盐反应生成弱酸;硝酸具有挥发性,且硝酸能和硅酸钠反应生成硅酸.
解答 解:(1)A的名称是分液漏斗;缓冲装置能防止倒吸,倒置的干燥管有缓冲作用,能防止倒吸,
故答案为:分液漏斗;防倒吸;
(2)元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,高锰酸钾和浓盐酸反应生成氯气,氯气能和硫化钠溶液反应生成S沉淀,该反应中氧化剂是氯气、氧化产物是S,则氧化性氯气大于S,非金属性Cl>S,所以看到的现象是有淡黄色沉淀生成,离子方程式为S2-+Cl2=S↓+2 Cl-;氯气有毒,不能直接排空,可以用碱液吸收防止污染大气,如用NaOH溶液吸收氯气;
故答案为:硫化钠;有淡黄色沉淀生成;S2-+Cl2=S↓+2 Cl-;氢氧化钠溶液;
(3)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,所以非金属性强弱顺序是N>C>Si;强酸能和弱酸盐反应生成弱酸,所以可以用稀硝酸和碳酸钙制取二氧化碳,用二氧化碳和硅酸钠溶液反应生成硅酸,从而确定酸性强弱,故选①③④;硝酸具有挥发性,且硝酸能和硅酸钠反应生成硅酸,干扰二氧化碳的检验,
故答案为:N、C、Si;①③④;硝酸有挥发性,随二氧化碳一起逸出.
点评 本题以非金属性强弱判断为载体考查性质实验方案设计,明确元素周期律、物质性质是解本题关键,注意(3)中硝酸的挥发性及其对碳酸酸性检验的干扰,为易错点.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案①500mL 0.1mol/L 的盐酸溶液; ②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液; ④1L 0.1mol/L 的酒精溶液.
| A. | ①②③④ | B. | ④①③② | C. | ②①③④ | D. | ①③②④ |
| A. | CH4分子的球棍模型: | B. | 羟基的电子式: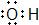 | ||
| C. | 醛基的结构简式:-CHO或HOC- | D. | 乙烯的实验式:CH2 |
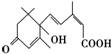 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )| A. | S-诱抗素含有碳碳双键、羟基、羰基、羧基 | |
| B. | S-诱抗素分子式为C16H18O2 | |
| C. | S-诱抗素能发生加成反应、水解反应、氧化反应 | |
| D. | 1mol S-诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
| A. | CCl4的电子式 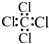 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
| A. | NaAlO2溶液滴入NaHCO3中:H++AlO2-+H2O=Al(OH)3↓ | |
| B. | 向FeI2溶液中滴加少量氯水:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 将2.24g铁粉投入400mL 0.3 mol/L的稀HNO3中:4Fe+12H++3NO3-=Fe3++3Fe2++3NO↑+6 H2O | |
| D. | 向含0.5 mol的明矾溶液中逐滴加入0.9 mol Ba(OH)2:5Al3++9SO42-+9Ba2++15OH-=9BaSO4↓+5Al(OH)3↓ |
 系统法命名:2,4-二甲基-3-乙基己烷.
系统法命名:2,4-二甲基-3-乙基己烷.