题目内容
3.请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1mol/L,体积是20mL,NaOH溶液足量.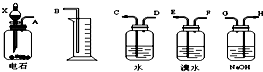
(1)实验室制取乙炔的化学方程式:CaC2+2H2O=Ca(OH)2+CH≡CH↑
(2)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是(填A、B、…)
A 接H;G 接E;F 接D;C 接B.
(3)为了使实验中气流平稳,液体X通常用饱和食盐水.
(4)实验中盛溴水的瓶中可观察到的现象是溴水褪色,(且容器底部有少量油状液体).
(5)若在标准状况下进行上述实验,假定溴水(与乙炔)完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL溶液,则生成乙炔的产率为:$\frac{\frac{V}{22.4}+\frac{0.1×0.02}{2}}{a}$×100%
(只需列出算式),如果不使用氢氧化钠溶液,会导致所测产率偏高(偏高、偏低或无影响)
分析 (1)碳化钙与水反应生成氢氧化钙和乙炔;
(2)根据实现的步骤:制备、净化、检验、收集来确定装置的连接顺序;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(4)乙炔能与溴发生加成反应,溶液褪色;
(5)根据溴单质的物质的量求出消耗的乙炔的量,再根据水的体积求出乙炔的体积,然后根据乙炔求出碳化钙的量,再求质量分数.
解答 解:(1)碳化钙与水反应生成氢氧化钙和乙炔,化学方程式:CaC2+2H2O=Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O=Ca(OH)2+CH≡CH↑;
(2)通过A装置制备气体,接着通过氢氧化钠溶液除去硫化氢,通过溴水检验是否生成乙炔,最后通过排水法收集气体,正确连接顺序是AHGEFDCB,
故答案为:AHGEFDCB;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流,故答案为:饱和食盐水;
(4)乙炔能与溴发生加成反应,溶液褪色,故答案为:溶液褪色;
(5)溴水与乙炔恰好完全反应生成C2H2Br4,溴单质的物质的量为0.1mol/L×0.02L,消耗的乙炔为:$\frac{0.1mol/L×0.02L}{2}$,测得排入量筒内液体体积为VmL(标况),则乙炔的体积为VL,其物质的量为$\frac{V}{22.4L/mol}$=$\frac{V}{22.4}$mol,所以反应的乙炔的总物质的量为$\frac{0.1mol/L×0.02L}{2}$+$\frac{V}{22.4}$mol,所以电石纯度可表示为$\frac{\frac{V}{22.4}+\frac{0.1×0.02}{2}}{a}$×100%,故答案为:$\frac{\frac{V}{22.4}+\frac{0.1×0.02}{2}}{a}$×100%.
点评 本题为实验题,考查了乙炔的制备,乙炔的性质,实验数据的分析和计算,熟悉实验过程和原理是解题关键,题目难度中等.

 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | 在光照条件下,甲烷与氯水发生取代反应 | |
| B. | 有机反应中,卤代、硝化、磺化、酯化、水解反应等不完全是取代反应 | |
| C. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 | |
| D. | 若烃中碳、氢元素的质量分数相同.它们必定是同系物 |
| A. | 标准状况下,22.4L H2O含有的分子数等于0.1NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 常温常压下,1 mol 甲烷分子中所含质子数为10NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
| A. | 氢气的摩尔质量是2克 | |
| B. | 1摩尔任何物质的质量通常叫做该物质的摩尔质量 | |
| C. | 1摩尔H2SO4的质量是98克/摩 | |
| D. | 氢气的摩尔质量是1g/mol |
| A. | O2和O3 | B. | CH3CH2CH2CH3和 | C. | 12C和14C | D. | CH4和CH3CH3 |
| A. | 淀粉、脂肪和蛋白质都是人体必需的高分子化合物 | |
| B. | 汽油、柴油和植物油都是碳氢化合物 | |
| C. | 高压聚乙烯是无毒高分子化合物,可用作食品包装袋等薄膜制品 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |

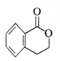
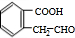
 +H2O$→_{△}^{稀H_{2}SO_{4}}$
+H2O$→_{△}^{稀H_{2}SO_{4}}$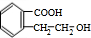 +CH3OH③F→G:2
+CH3OH③F→G:2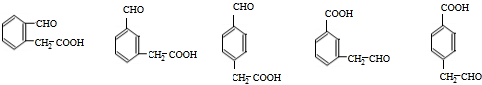 等
等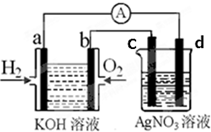 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)