题目内容
20.某校化学课外兴趣小组的同学在研究性学习课上展示了一套如图所示实验装(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4$\frac{\underline{\;浓硫酸\;}}{加热}$CO↑+CO2↑+H2O.通过讨论,同学们对这套装置有了多种认识.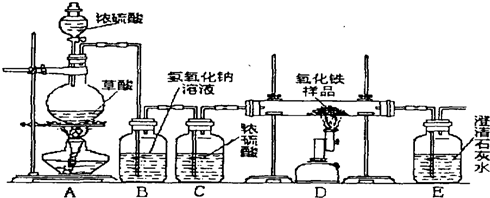
(1)第一小组的同学说:用该实验装置可以检验一氧化碳与氧化铁反应的产物,其中B装置的作用吸收CO2;E装置的作用检验D中的氧化产物;一氧化碳与氧化铁反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)第二小组的同学说:利用这套装置还可以测定氧化铁样品中氧化铁的质量分数.他们的测定方法是:称取氧化铁样品10.0g,完全反应并冷却后再称量剩余固体的总质量为7.6g.计算实验测得氧化铁样品中氧化铁的质量分为80%.
(3)第三小组同学说:利用这套装置还有其它测定样品中氧化铁的质量分数的方法:先称量氧化铁样品的质量,再分别称量E装置在反应前后的总质量,即可计算求得样品中氧化铁的质量分数.但按此方法实际实验测定结果却偏大,分析造成这种误差的原因可能是E中可能吸收草酸分解生成的部分二氧化碳及CO还原氧化铁生成的二氧化碳,还可能吸收空气中的二氧化碳.
分析 由实验装置可知,A中发生H2C2O4$\frac{\underline{\;浓硫酸\;}}{加热}$CO↑+CO2↑+H2O,B中NaOH溶液吸收CO2,C中浓硫酸干燥CO气体,D中发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,E中石灰水检验D中的氧化产物,以此来解答.
解答 解:(1)B装置的作用为吸收CO2,D中发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,E中石灰水检验D中的氧化产物,
故答案为:吸收CO2;检验D中的氧化产物;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)设氧化铁样品中氧化铁的质量为xg,则
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 △m
160 48
x (10g-7.6g)
解得x=0.8g,
则氧化铁样品中氧化铁的质量分数为$\frac{0.8g}{10g}$×100%=80%,
故答案为:80%;
(3)由实验装置可知,B吸收二氧化碳可能不充分,E中可能吸收草酸分解生成的部分二氧化碳及CO还原氧化铁生成的二氧化碳,还可能吸收空气中的二氧化碳,则分别称量E装置在反应前后的总质量,导致二氧化碳的质量偏大,利用D中反应计算氧化铁的质量分数偏大,
故答案为:E中可能吸收草酸分解生成的部分二氧化碳及CO还原氧化铁生成的二氧化碳,还可能吸收空气中的二氧化碳.
点评 本题考查性质实验及实验装置综合,为高频考点,把握物质的性质、实验装置的作用及含量测定为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | O2和O3 | B. | CH3CH2CH2CH3和 | C. | 12C和14C | D. | CH4和CH3CH3 |
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| B | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| C | FeCl3(FeCl2)溶液 | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4)溶液 | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 淀粉、脂肪和蛋白质都是人体必需的高分子化合物 | |
| B. | 汽油、柴油和植物油都是碳氢化合物 | |
| C. | 高压聚乙烯是无毒高分子化合物,可用作食品包装袋等薄膜制品 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 足量Zn与一定量的浓硫酸反应,产生22.4L(标准状况)气体时转移的电子数一定为2NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
①用甲烷气体通入碘水制碘甲烷
②甲烷和溴蒸气混合光照制取纯净的一溴甲烷
③用酒精灯加热甲烷气体制取炭黑和氢气.
| A. | 只有① | B. | 只有③ | C. | 只有② | D. | ①②③ |

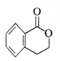
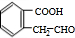
 +H2O$→_{△}^{稀H_{2}SO_{4}}$
+H2O$→_{△}^{稀H_{2}SO_{4}}$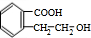 +CH3OH③F→G:2
+CH3OH③F→G:2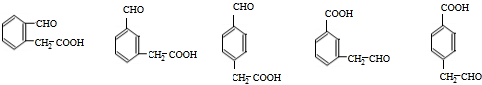 等
等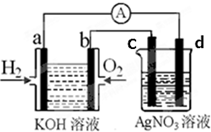 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)