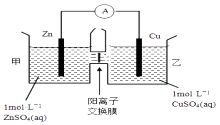
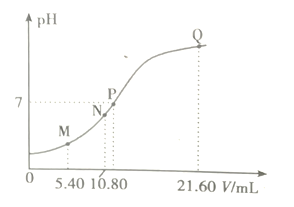
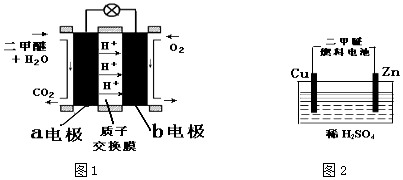
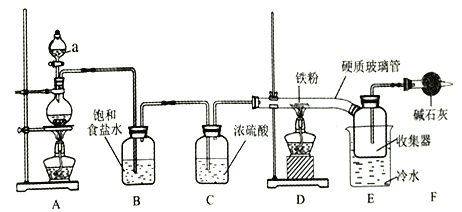
题目内容
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下: 【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大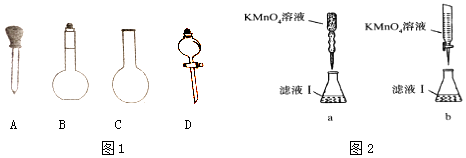
该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整: Fe2++MnO4﹣+=Mn2+++ .
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是 . (填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L﹣1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填偏高、偏低或不变).
(4)三次操作读数如下:
序号 | V初 | V末 | V标 |
① | 0.10mL | 9.71mL | 9.61mL |
② | 1.50mL | 11.09mL | 9.59mL |
③ | 0.50mL | 11.10mL | 11.60mL |
计算该“速力菲”补铁药品Fe2+的氧化率为%.
【答案】
(1)5;1;1;5Fe3+;4H2O
(2)烧瓶(园底烧瓶)分液漏斗
(3)b;偏高
(4)16
【解析】解:(1)MnO4﹣中Mn的化合价由+7价降为+2价,变化5,Fe2+中Fe由+2价升为+3价,变化1价,根据化合价升降总数相等和质量守恒得:MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O,
所以答案是:5,1,8H+,1,5Fe3+,4H2O;(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是分液漏斗、圆底烧瓶,
所以答案是:烧瓶(园底烧瓶) 分液漏斗;(3)酸性高锰酸钾溶液具有强氧化性,应该用酸式滴定管盛放,所以a错误、b正确,若滴定过程中,锥形瓶中待测液飞溅出来,测定的亚铁离子增大,亚铁离子氧化率增大,
所以答案是:b;偏高; (4)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,铁元素质量=20.00%×20.0g=4.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L﹣1的KMnO4溶液滴定,分析可知标准溶液体积.实验3误差太大舍去,平均消耗标准溶液体积V= ![]() =9.6ml,
=9.6ml,
MnO4﹣+ | 5Fe2++8H+═Mn2++5Fe3++4H2O |
1 | 5 |
0.0096L×0.1000mol/L﹣1 | n |
n=0.0048mol,
配制成250ml溶液中铁元素物质的量= ![]() ×0.0048mol=0.06mol,
×0.0048mol=0.06mol,
该“速力菲”补铁药品Fe2+的转化率= ![]() ×100%=84%,
×100%=84%,
国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值),则该“速力菲”补铁药品Fe2+的氧化率为16%,
所以答案是:16.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变