��Ŀ����
����Ŀ��ʵ���ҿ��������ͽ�������Ӧ�Ʊ���ˮ�����������û�������غ�ɫ���׳��⣬100������ʱ������װ������:
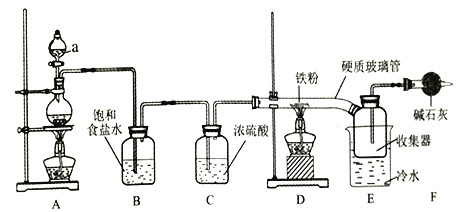
(1)����a��������________��
(2)A�з�Ӧ�Ļ�ѧ����ʽ��________��
(3)��ʯ�ҵ�������________��
(4)��Ӧ��ʼʱ���ȵ�ȼ_______���ľƾ���(�A����D��)��
(5)D�з�Ӧ��ʼ���ռ������д����غ�ɫ�����ɣ���Ӧ�������ռ�����Ӳ�ʲ������е����ʿ���ת������ƿ�У���ˮ�ܽ⣬��ַ�Ӧ����KSCN��Һδ���ɫ����ԭ����__________��(�����ӷ���ʽ��ʾ)��
���𰸡� ��Һ©�� MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O ������������ֹ��Ⱦ��������ֹ�������е�ˮ�������� E��ʹ�Ȼ������� A Fe+2Fe3+ === 3Fe2+
MnCl2+Cl2��+2H2O ������������ֹ��Ⱦ��������ֹ�������е�ˮ�������� E��ʹ�Ȼ������� A Fe+2Fe3+ === 3Fe2+
��������Ҫ��ȡ��������ˮFeCl3Ӧע�⣺����װ��B��D���������ڣ�����Eװ��(�ռ��Ȼ��������װ��)�Ҳ�����ˮװ�ã���δ��Ӧ��������β�����ݳ����������Ҫ������Cl2��װ�ã���NaOH��Һ���۲�ʵ��װ����Ƶ�˼·������������������Ӧ�������������������Ϣ�����Ȼ����׳��⣬���Bװ�����ݳ���Cl2������Cװ����ʢװŨ������Ϊϴ��ƿ��������һ���ܡ�Dװ���з�Ӧ������ˮ���Ȼ���������100 ������ʱ�����������뿪��Դ����ȴ�ɹ������ֿھ���Ӳ�ʲ�����ֱ�Ӳ����ռ����У������˶���������F������еļ�ʯ����������δ��Ӧ����������ֹ��Ⱦ������ͬʱҲ�ܷ�ֹˮ��������E���������Ȼ������⡣
(1) ����a�������Ƿ�Һ©����
��ˣ�������ȷ��������Һ©����
(2) A���ö������̺�Ũ�����������������Ӧ�Ļ�ѧ����ʽ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��ˣ�������ȷ������MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
(3)ͨ�����Ϸ�����֪����ʯ�ҵ�������������������ֹ��Ⱦ��������ֹ�������е�ˮ�������� E��ʹ�Ȼ���������
��ˣ�������ȷ������������������ֹ��Ⱦ��������ֹ�������е�ˮ�������� E��ʹ�Ȼ���������
(4) ��Ӧ��ʼʱ���ȵ�ȼA���ľƾ��ƣ����������ϳ�������
��ˣ�������ȷ������A ��
(5)��Ӧ�������ռ�����Ӳ�ʲ������е�����ΪFeCl3��ʣ���Fe����ˮ�ܽ⣬������ӦFe+2Fe3+ === 3Fe2+��Fe3+����ȫ��Ӧ�������KSCN��Һ�����ɫ��
�ʴ�Ϊ��Fe+2Fe3+ === 3Fe2+��

 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�����Ŀ���������岻��ȱ�ٵ���Ԫ�أ����뺬���Ļ�����ɲ��������������ơ����г���һ�ֳ����IJ���ҩƷ����˵���鲿������ժ¼���£� �����ÿƬ������������0.1g
����Ӧ֢������ȱ����ƶѪ֢��Ԥ���������ã�
�����ء��ܹ⡢�ܷ⡢�ڸ��ﴦ���森
��ҩ������á���ά����Cͬ���������ӱ�Ʒ���գ���ҩƬ��ˮ���Ҵ����ܽ�Ȳ���
��ҩƷ��Fe2+�Ỻ�����������ҹ涨��ҩ����Fe2+�������ʣ��Ѿ�������Fe2+��������Fe2+�������ı�ֵ������10.00% �������ٷ��ã�
��1��ʵ���ҿɲ���H2SO4�ữ��KMnO4��Һ���ԡ������ơ��е�Fe2+���еζ�������ҩƷ�������ɷݲ���KMnO4��Ӧ�����ζ����̷������·�Ӧ���벹�������� Fe2++MnO4��+=Mn2+++ ��
��2��ʵ��ǰ����������Ԫ����������Ϊ20.00%�ġ������ơ�20.0g������ȫ������ϡH2SO4�У����Ƴ�250ml��Һ������ʱͼ1���������϶�����Ҫ���� �� �������ƣ�
��3��ȡ���ƺõ���Һ20.00ml����ƿ�У���0.1000mol/L��1��KMnO4��Һ�ζ���ijͬѧ�����ͼ2�ζ���ʽ���гֲ�����ȥ�������������������ĸ��ţ������ζ������У���ƿ�д���Һ�ɽ�������������Fe2+������������ƫ�ߡ�ƫ�ͻ䣩��
��4�����β����������£�
��� | V�� | Vĩ | V�� |
�� | 0.10mL | 9.71mL | 9.61mL |
�� | 1.50mL | 11.09mL | 9.59mL |
�� | 0.50mL | 11.10mL | 11.60mL |
����á������ơ�����ҩƷFe2+��������Ϊ%��

