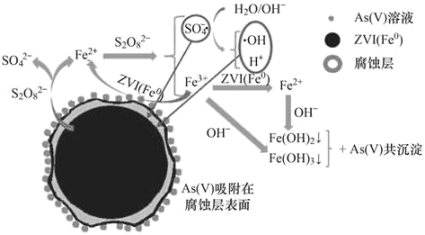
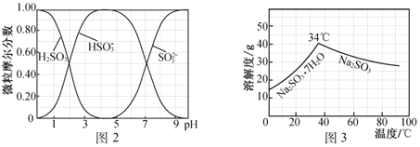
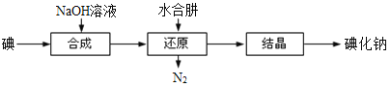
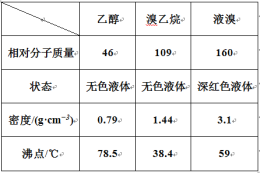
题目内容
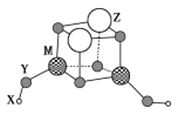
【题目】短周期元素 X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() ,下列说法正确的是
,下列说法正确的是
A.简单离子半径: Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X与Y结合形成的化合物是离子化合物
D.工业上常用电解Z的氯化物的熔融液来制取Z单质
【答案】D
【解析】
X、M的族序数均等于周期序数,结合团簇分子结合可知X为H,M为Be或Al,Y原子核外最外层电子数是其电子总数的![]() ,则Y为O,Y的原子序数小于M,则M为Al;根据团簇分子的结构可知其分子式应为Al2Z2H2O6,Z的化合价为+2价,则Z为Mg。
,则Y为O,Y的原子序数小于M,则M为Al;根据团簇分子的结构可知其分子式应为Al2Z2H2O6,Z的化合价为+2价,则Z为Mg。
A.离子核外电子层数相同时,原子序数越小其半径越小,所以简单离子半径:O2->Mg2+>Al3+,故A错误;
B.常温下金属铝与浓硝酸会钝化,故B错误;
C.X与Y形成的化合物为H2O2或H2O,均为共价化合物,故C错误;
D.Z为Mg,工业上常电解熔融状态下的氯化镁制取镁单质,故D正确;
故答案为D。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
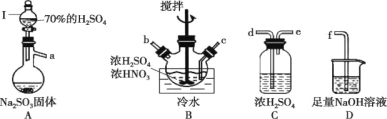
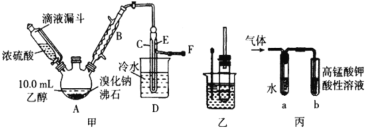
【题目】某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。下列说法正确的是
试管 | ① | ② | ③ | ④ |
实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |
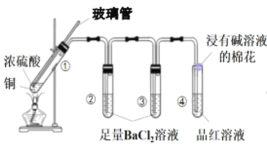
A.②中白色沉淀是BaSO3
B.①中可能有部分浓硫酸挥发了
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变