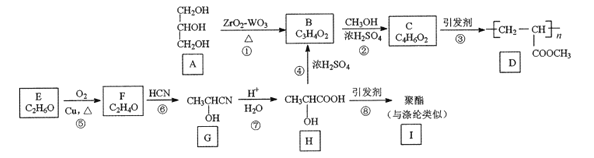
题目内容
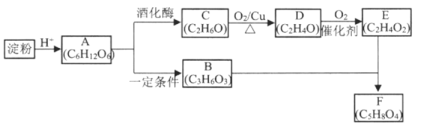
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0
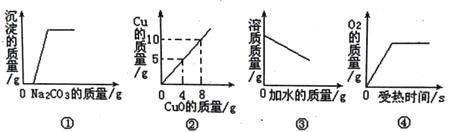
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示。以下说法正确的是___________(填对应字母)。
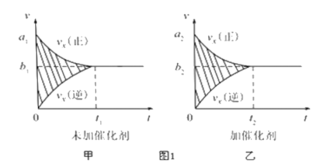
A. a1>a2 B.b1<b2 C.t1>t2 D.图乙中阴影部分面积更大E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol
N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________。
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”)。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________。
CO+3H2的平衡常数K=______________。
【答案】BC BD CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H= 898.1 kJ·mol1 吸热 6.75
【解析】
⑴①加了催化剂,反应速率增大,反应达到平衡所需时间缩短,阴影面积为反应物消耗的量。
②若该反应在绝热、恒容的密闭体系中进行,A. 反应是放热反应,达到平衡是正、逆反应速率相等,t1时刻正反应速率最大,之后随着反应进行速率减小,说明未达到平衡;B. K平衡常数不变,说明容器内温度一定,反应达到平衡;C. t1时刻CO、CO2质量还在发生改变,说明未达到平衡;D. NO的质量分数为定值,说明达到平衡。
⑵根据盖斯定律,第一个方程式减去第二个方程式,再加上第三个方程式的2倍。
⑶①升高温度,平衡常数增大,说明平衡正向移动。
②三段式建立关系,再根据平衡常数公式进行计算。
⑴①加了催化剂,反应速率增大,反应达到平衡所需时间短,阴影面积为反应物消耗的量,由于加催化剂,平衡不移动,因此反应物消耗的量不变,因此a2>a1,b1<b2,t1>t2,两图中阴影部分面积相等,故BC正确。
②若该反应在绝热、恒容的密闭体系中进行,A. 反应是放热反应,达到平衡是正、逆反应速率相等,t1时刻正反应速率最大,之后随着反应进行速率减小,说明未达到平衡,故A不符合题意;B.K平衡常数不变,说明容器内温度一定,反应达到平衡,故B符合题意;C. t1时刻CO、CO2质量还在发生改变,说明未达到平衡,故C不符合题意;D. NO的质量分数为定值,说明达到平衡,故D符合题意;综上所述,答案为BD。
⑵根据盖斯定律,第一个方程式减去第二个方程式,再加上第三个方程式的2倍,得到CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g) + N2O4(g) = N2(g) + 2H2O(l) + CO2(g) △H= 898.1 kJ·mol1;故答案为:CH4(g) + N2O4(g) = N2(g) + 2H2O(l) + CO2(g) △H= 898.1 kJ·mol1。
⑶①升高温度,平衡常数增大,说明平衡正向移动,正向为吸热反应;故答案为:吸热。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5 molL1,则n(CH4)=0.5 mol,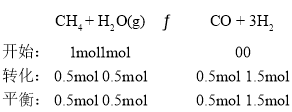 ,该温度下反应CH4+H2O
,该温度下反应CH4+H2O![]() CO+3H2的平衡常数
CO+3H2的平衡常数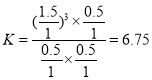 ;故答案为:6.75。
;故答案为:6.75。

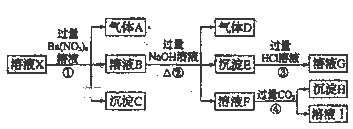
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
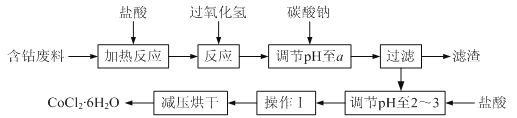
已知:①CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,易失去结晶水变成有毒的无水氯化钴。(乙醚:无色液体,沸点34.5℃,在水中的溶解度小)
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)钴的性质与铁相似,能与盐酸和硝酸反应,写出钴与盐酸反应的化学方程式:________________________________。
(2)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点:
①为__________________________,防止大气污染;
②防止产品中混有硝酸盐。
(3) 加入碳酸钠调节pH至a,a的范围应是5.2~_________。
(4) 操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和_________。
(5)根据表中数据,判断Ksp[Fe(OH)3] ________Ksp[Co(OH)2] (填“<”、“=”或“>”) 。在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是:将产品溶于乙醚过滤后,再蒸馏。