题目内容
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
【答案】-34 ac 温度 L1>L2,正反应是气体分子数减小的反应,增大压强,平衡转化率增大 0<a<2 4L/moL(也可不带单位) 1-b
【解析】
I.(1)依据化学反应焓变=反应物键能总和-生成物键能总和来分析;
(2)当达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,可以此判断是否达到平衡状态;
(3)根据(1)问可知,反应①为放热反应,且随着反应的进行,混合气体总物质的量减少,根据压强、温度对反应①平衡的影响进行分析;
II.(4)当物质的量不变时平衡,此时隔板K、F不再移动,根据可逆反应的特征用极限法分析;
(5)根据化学平衡常数表达式的概念,结合条件和给出的可逆反应方程式解答;
(6)根据恒温恒容下等效平衡规律分析计算;
I.(1)CH2=CH2(g)+H2O(g)CH3CH2OH(g)的焓变ΔH1=反应物总键能之和-生成物总键能之和,结合图表提供的化学键的键能,则△H1═615 kJ/mol +4×413 kJ/mol+2×463 kJ/mol -(5×413kJ/mol+348 kJ/mol+351 kJ/mol+463 kJ/mol)=3193 kJmol-1-3227 kJmol-1=-34 kJmol-1,
故答案为:-34;
(2) a. 2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g),正反应气体物质的量减小,随反应进行混合气体总物质的量减少,恒容容器中,容器内总压强减小,容器内总压强保持不变,说明到达平衡状态;
b. H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率都属于正反应速率,正反应速率之比等于计量数之比,不能说明到达平衡状态;
c. 气体的总质量保持不变,气体总物质的量减少,则气体的平均摩尔质量逐渐增大,当容器中混合气体的平均摩尔质量保持不变,说明到达平衡状态;
d. 在恒容密闭容器中发生反应②,气体的总质量保持不变,气体的密度始终保持不变,因此当容器内混合气体密度保持不变时,不能说明达到平衡状态;
答案选ac;
(3)①反应①为2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH1=-34 kJ·mol-1(第1小问已得出结论),该反应的正反应是放热反应,且气体分子数减小;若增大压强,平衡正向移动,乙烯的平衡转化率增大,与图像不吻合,x不可能为压强;若升高温度,平衡向逆反应方向移动,乙烯的平衡转化率减小,与图像吻合,x可能为温度;因此横坐标x代表温度,
故答案为:温度;
②横坐标为温度,则L1与L2代表压强对乙烯平衡转化率的影响曲线,因增大压强,平衡向正反应方向进行,乙烯的平衡转化率增大,所以L1>L2,
故答案为:L1>L2,正反应是气体分子数减小的反应,增大压强,平衡转化率增大;
II.(4)甲、乙之间的隔板K和活塞F都可左右移动,此时甲、乙是恒温恒压容器,根据反应式2A(g)+B(g)2C(g)可知甲中反应达平衡时气体物质的量减小,乙中反应达到平衡时气体物质的量增大,当物质的量不变时平衡,此时隔板K、F不再移动;通过观察,当反应未开始时隔板位于0处,每一个格相当于0.5 mol气体。隔板在a处时,甲中的气体为0.5×(6a)mol;设甲中反应到达平衡时,有x mol B发生反应,
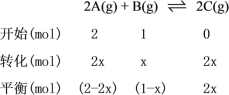 则(22x)+(1x)+2x=(6a)×0.5 0.5a=x
则(22x)+(1x)+2x=(6a)×0.5 0.5a=x
当B完全反应时,x=1,a取最大,即a=2;当B没有反应时,x=0,a取最小,即a=0;根据可逆反应达到平衡的特点,K停留在02之间某位置,
故答案为:0<a<2;
(5)根据题中的条件,当到达平衡时,隔板位于左侧1处,则说明甲中平衡时气体物质的量为0.5×(61)mol =2.5mol,设甲中到达平衡时有y mol B反应,
2A(g)+B(g)2C(g)
开始(mol)2 1 0
转化(mol)2y y 2y
平衡(mol)2-2y 1-y 2y
2-2y+1-y+2y=2.5,解得y=0.5,甲容积为2L,则甲平衡时A、B、C物质的量浓度依次为0.5mol/L、0.25mol/L、0.5mol/L,根据化学平常数表达式的概念,该反应的平衡常数![]() ,
,
故答案为:4L/moL(可不带单位);
(6)若一开始就将K、F固定,则甲、乙为恒温恒容容器,甲中起始充入2molA和1molB,与乙中起始充入2molC达到平衡时为完全全等的等效平衡,恒温恒容时乙中的氦气对平衡无影响;甲容器中A的转化率为b,则A转化了2b,平衡时C为2b;乙容器中平衡时含有2b的C物质,乙中C的转化率=![]() = 1b;
= 1b;
故答案为:1b。




