题目内容
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 | |
| D. | 某密闭容器盛有0.1molN2,0.3molH2,在一定条件下反应,转移的电子数为0.6NA |
分析 A、溶液体积不明确;
B、Zn与浓硫酸反应的离子方程式为Zn+SO42-+4H+=Zn2++SO2↑+2H2O,随着反应的进行,硫酸浓度逐渐降低,当为稀硫酸时,发生Zn+2H+=ZnSO4+H2↑,根据参与反应的H+的物质的量与转移电子的物质的量之间的对应关系来分析;
C、根据反应后镁元素的化合价来分析;
D、合成氨的反应为可逆反应.
解答 解:A、溶液体积不明确,故溶液中ClO-的个数无法计算,故A错误;
B、Zn与浓硫酸反应的离子方程式Zn+SO42-+4H+=Zn2++SO2↑+2H2O可知,H+先反应完,且4molH+参与反应时转移2mol电子,故如果1mol浓硫酸与锌均按此反应进行,则转移的电子为1mol;当为稀硫酸时,发生Zn+2H+=ZnSO4+H2↑,而此反应中,2molH+参与反应时转移2mol电子,故如果1molH2SO4均和锌按此反应进行,则转移2mol电子;而含1molH2SO4的浓硫酸和足量的锌反应时,硫酸浓度逐渐降低,故转移的电子应介于1mol-2mol之间,故B错误;
C、反应后镁元素的化合价为+2价,故1mol镁转移2mol电子,失去2NA个电子,故C正确;
D、合成氨的反应为可逆反应,不能进行彻底,故反应转移的电子数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知甲醛(HCHO)分子中的4个原子是共平面的.下列分子中所有原子不可能同时存在于同一个平面上的是( )
| A. |  苯乙烯 苯乙烯 | B. | 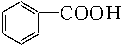 苯甲酸 苯甲酸 | C. | 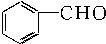 苯甲醛 苯甲醛 | D. |  苯乙酮 苯乙酮 |
4. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
8.实验室利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O,关于该反应的下列说法正确的是( )
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |

 、
、 ;
;
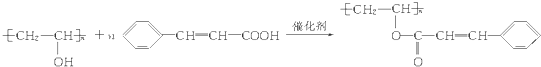 .
.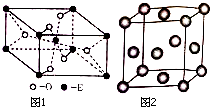 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同. .
.