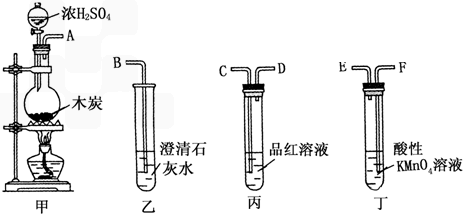
题目内容
10.物质A-H有如图所示转化关系(有些产物没有列出).其中,B是一种极易溶于水的气体,G是难溶于水的蓝色固体.
试填写下列空白:
(1)写出Cu与H的浓溶液反应的化学方程式:Cu+4HNO3?═Cu(NO3)2+2NO2↑+2H2O;
(2)写出反应④的离子方程式:Cu+4H++2NO3-?═Cu2++2NO2↑+2H2O;
(3)用电子式表示A和B的形成过程:
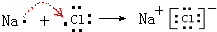 、
、 ;
;(4)用惰性电极电解F的水溶液时,两极的电极反应式为:正极2H2O-4e-=O2↑+4H+;负极2Cu2++4e-=2Cu.
分析 B是一种极易溶于水的气体,且B是由A与浓硫酸微热得到,且B能与氢氧化钠反应生成A,则B为HCl,所以A为NaCl,NaCl与浓硫酸微热生成C为NaHSO4,与铜、硝酸钠共热生成NO2、硫酸铜、硫酸钠,D能与氧气、水反应生成H,则D为NO2,H为HNO3,F能与氢氧化钠反应生成G和E,G是难溶于水的蓝色固体,则G为Cu(OH)2,F为CuSO4,所以E为Na2SO4,NaHSO4与Cu(OH)2反应生成Na2SO4、硫酸铜、水,符合转化关系,据此答题.
解答 解:B是一种极易溶于水的气体,且B是由A与浓硫酸微热得到,且B能与氢氧化钠反应生成A,则B为HCl,所以A为NaCl,NaCl与浓硫酸微热生成C为NaHSO4,与铜、硝酸钠共热生成NO2、硫酸铜、硫酸钠,D能与氧气、水反应生成H,则D为NO2,H为HNO3,F能与氢氧化钠反应生成G和E,G是难溶于水的蓝色固体,则G为Cu(OH)2,F为CuSO4,所以E为Na2SO4,NaHSO4与Cu(OH)2反应生成Na2SO4、硫酸铜、水,符合转化关系,
(1)Cu与硝酸的浓溶液反应的化学方程式为Cu+4HNO3?═Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3?═Cu(NO3)2+2NO2↑+2H2O;
(2)反应④为酸性条件下,硝酸根氧化铜,反应的离子方程式为Cu+4H++2NO3-?═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-?═Cu2++2NO2↑+2H2O;
(3)A为NaCl,是离子化合物,B为HCl,是共价化合物,用电子式表示A的形成过程为: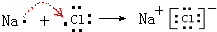 ,B的形成过程为
,B的形成过程为 ,
,
故答案为: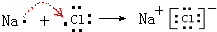 ;
; ;
;
(4)F为CuSO4,用惰性电极电解F的水溶液时,两极的电极反应式为:阳极2H2O-4e-=O2↑+4H+;阴极2Cu2++4e-=2Cu,
故答案为:2H2O-4e-=O2↑+4H+;2Cu2++4e-=2Cu.
点评 本题考查无机物推断,解题关键是酸式盐与NaCl反应生成气体,这是实验室制备HCl的反应,也是本题的难点,注意(4)电极反应式书写中电子转移守恒,难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案(1)砷原子核外电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道).
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH(CH3)CH2Br | ||
| C. | CH3CHBrCH2CH2Br | D. | CH3CH2Br |
| A. | 分离工业废水,回收废液中的有用成分 | |
| B. | 将化学能转换成电能,将热能转换成电能 | |
| C. | 食品工业中,浓缩天然果汁、乳制品加工和酿酒 | |
| D. | 海水淡化 |
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 | |
| D. | 某密闭容器盛有0.1molN2,0.3molH2,在一定条件下反应,转移的电子数为0.6NA |