题目内容
【题目】某化学兴趣小组,在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
NaCl | MgCl2 | AlCl3 | SiCl4 | CaCl2 | |
熔点/℃ | 801 | 712 | 190 | -68 | 782 |
沸点/℃ | 1 465 | 1 418 | 230 | 57 | 1 600 |
根据这些数据分析,他们认为属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2
B.AlCl3、SiCl4
C.NaCl、CaCl2
D.NaCl、MgCl2、AlCl3、SiCl4、CaCl2
【答案】B
【解析】分子晶体的熔、沸点低。

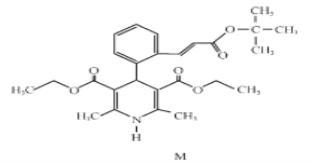
【题目】某课外学习小组在学习了![]() 与
与![]() 的反应后,认为
的反应后,认为![]() 与
与![]() 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究
进行实验,探究![]() 与
与![]() 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
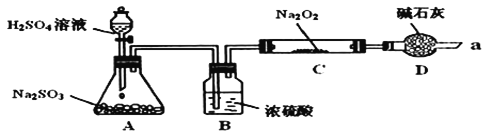
Ⅰ![]() 写出装置A中发生反应的化学方程式:______。
写出装置A中发生反应的化学方程式:______。
Ⅱ![]() 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的![]() 、水蒸气等进入C中与
、水蒸气等进入C中与![]() 反应,还可以______________________________________________________。
反应,还可以______________________________________________________。
Ⅲ![]() 在通入足量的
在通入足量的![]() 与
与![]() 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有![]() ;
;
假设2:___________;
假设3:既有![]() ,又有
,又有![]() 。
。
(1)若假设2成立,写出![]() 与
与![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
步骤![]() 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性![]() 溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。
溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。![]() 选填1、2或
选填1、2或![]()
【题目】由C、H、O组成的化合物8.80mg,完全燃烧后得二氧化碳22.0mg,水10.8mg。该化合物的实验式(最简式)是( )
A. C5H6OB. C5H12C. C5H12O2D. C5H12O
【题目】SO2是常见的硫氧化物,在化工、生活等领域中应用广泛。
I如图是实验室制取SO2并验证SO2某些性质的装置图
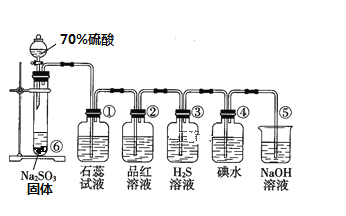
(1)⑥中发生反应的化学方程式为_________________________________
(2)③中实验现象为_____________________________________,证明SO2有____性
(3)⑤中离子反应方程式为______________________
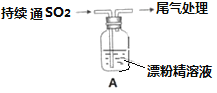
II某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________________
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是_______________________________________________
②由实验a、b不能判断白雾中含有HCl,理由是_______________________________________
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是___________
②用离子方程式解释现象iii中黄绿色褪去的原因 ___________________________