题目内容
【题目】SO2是常见的硫氧化物,在化工、生活等领域中应用广泛。
I如图是实验室制取SO2并验证SO2某些性质的装置图
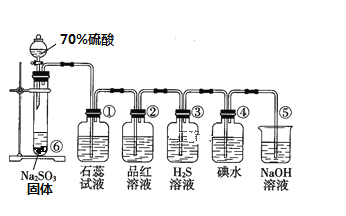
(1)⑥中发生反应的化学方程式为_________________________________
(2)③中实验现象为_____________________________________,证明SO2有____性
(3)⑤中离子反应方程式为______________________
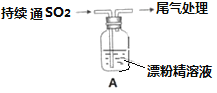
II某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________________
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是_______________________________________________
②由实验a、b不能判断白雾中含有HCl,理由是_______________________________________
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是___________
②用离子方程式解释现象iii中黄绿色褪去的原因 ___________________________
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 有淡黄色沉淀产生 氧化 SO2+2OH-=SO32-+ H2O 碱性、漂白性 检验白雾中是否含有氯气,排除干扰 白雾中混有SO2,SO2可与硝酸银反应 CaSO4 SO2+Cl2+2H2O=SO42-+2Cl-+4H+
【解析】
I(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体;
(2)③中二氧化硫与硫化氢发生氧化还原反应生成单质S;
(3)⑤的作用是吸收二氧化硫,防止二氧化硫污染空气;
II(1)漂粉精的pH约为12,大于7,说明溶液显碱性,后褪色说明具有漂白性;
(2)①实验a的目的是检验白雾中是否含有氯气;
②白雾中混有SO2,可以被硝酸氧化为硫酸,硫酸与AgNO3溶液反应生成硫酸银白色沉淀;
(3)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸和硫酸。
I(1)⑥中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,SO2+2H2S=3S↓+2H2O,实验现象为有淡黄色沉淀产生,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,故答案为:有淡黄色沉淀产生;氧化;
(3)⑤的作用是吸收二氧化硫,防止二氧化硫污染空气,化学方程式为:
SO2+2NaOH=Na2SO3+ H2O,离子反应方程式为SO2+2OH-=SO32-+ H2O,故答案为:SO2+2OH-=SO32-+ H2O;
II(1)漂粉精的pH约为12,大于7,说明溶液显碱性,后褪色说明具有漂白性,故答案为:碱性、漂白性;
(2)①实验a的目的是检验白雾中是否含有氯气,如果有氯气,湿润的碘化钾淀粉试纸变蓝,故答案为:检验白雾中是否含有氯气,排除干扰;
②白雾中混有SO2,可以被硝酸氧化为硫酸,硫酸与AgNO3溶液反应生成硫酸银白色沉淀,故答案为:白雾中混有SO2,SO2可与硝酸银反应;
(3)①取上层清液,加入BaCl2溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4,故答案为:CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸和硫酸,反应方程式为
SO2+Cl2+2H2O=SO42-+2Cl-+4H+,故答案为: SO2+Cl2+2H2O=SO42-+2Cl-+4H+。