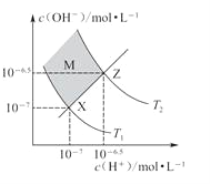
题目内容
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
【答案】酸式滴定管(或移液管) c 草酸分解 生成的 Mn2+对反应具有催化作用 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O 滴入一滴KMnO4溶液后,锥形瓶中液体由无色变为浅红色且半分钟内不恢复原色 ![]() 偏高
偏高
【解析】
(1)②中移取10.00mLH2O2待测液具有氧化性,能腐蚀乳胶管,所用主要仪器名称为酸式滴定管(或移液管);(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,KMnO4标准液具有强氧化性,该过滤操作需用不需滤纸的微孔玻璃漏斗,故选C;(3)温度过高可能会因草酸分解而导致KMnO4标准液的标定浓度偏高;开始时反应速率较慢,随后加快,导致速率加快的原因是 生成的 Mn2+对反应具有催化作用;(4)KMnO4标准液滴定H2O2,KMnO4还原成Mn2+,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;当滴定到滴入一滴KMnO4溶液后,锥形瓶中液体由无色变为浅红色且半分钟内不恢复原色可以认为已达到滴定终点。
(5)先求出KMnO4标准液的浓度
5H2C2O4 + 2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5mol 2mol
mg/134g·mol-1 cV1×10-3L
![]()
c=![]() mol·L-1
mol·L-1
该医用消毒剂中H2O2的物质的量浓度为
2MnO4- + 5H2O2+6H+=2Mn2++5O2↑+8H2O
2mol 5mol
cV2×10-3L c2×25×10-3L×10/500
![]()
c2=![]() mol·L-1
mol·L-1
(6)②中若用盐酸代替H2SO4,盐酸也能与标准液反应,测定结果将偏高。

【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性