题目内容
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
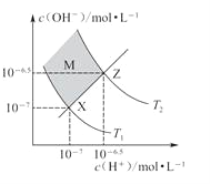
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
【答案】D
【解析】
试题A、由图像知,两曲线上的任意点均是平衡点,且温度一定,所以其水的离子积是一个常数,A正确;B、当c(H+)=10-7mol/L时,向上作垂线得在M区域内c(OH-)>10-7mol/L,B正确;C、水的电离是吸热反应,升温促进水电离,c(H+)、c(OH-)及Kw都增大,所以T1<T2,C正确、D、X曲线在25℃时c(H+)=10-7mol/L,pH=7,而Z曲线温度高于25℃,其pH<7,D错误。答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目