��Ŀ����
��֪���Ϊ2L�ĺ����ܱ������з�����Ӧ��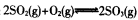 ������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
��1��һ�������£�����2 mol SO2��g����2 mol O2��g����20 s���SO2������ٷֺ���Ϊ12��5%������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ____����ʱ�����ܱ������ڻ�������ѹǿ�Ƿ�Ӧǰ��____����
��2���������������Ϊ�жϣ�1���п��淴Ӧ�ﵽƽ��״̬���ݵ��ǣ�����ţ�____��
��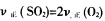
�ڻ��������ܶȲ���
�ۻ�������ƽ����Է�����������
�ܸ������Ũ�ȶ����ٷ����仯
��3����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���ı仯�Ĺ�ϵ�������в�ͬʱ����У�SO3�İٷֺ�����ߵ��ǣ� ��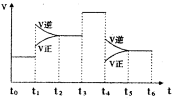

��ͼ����������Ϊt3ʱ�ı��������������� ��
t6ʱ���������������ϵ�г�������SO3���ٴ�ƽ���
SO2������ٷֺ�����t6ʱ �����\��С�����ڡ�����
��4����ͼ��P�ǿ�����ƽ�л����Ļ���������ͬ�¶�ʱ����A�����г���4 mol SO3��g�����ر�K����B�����г���2 mol SO3��g�����������ֱ�����Ӧ��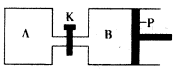
��֪��ʼʱ����A��B�������ΪaL���Իش�
�ٷ�Ӧ�ﵽƽ��ʱ����B�����Ϊ1��2a L������B��SO3ת
����Ϊ____
������K��һ��ʱ������´ﵽƽ�⣬����B�����Ϊ __L����ͨ��������������Բ��ƣ��Ҳ������¶ȵ�Ӱ�죩��
��5����֪�������ȼ����Ϊ��H=-296kJ/mol�����ⶨ��S��s������120gSO3��g���ɷ���592��5kJ����д��SO2��g����������SO3��g�����Ȼ�ѧ����ʽ____��
��1��0.04mol/(L��s)(2��) 0.8��(2��)
��2���ۢ�(2��)
��3��A(1��) �������(1��) С(1��)
��4��40�G(2��) 2.6a(2��)
��5��2SO2 (g) + O2 (g)  2SO3 (g)����H�� ��198 kJ��mol-1(2��)
2SO3 (g)����H�� ��198 kJ��mol-1(2��)
���ߣ� SO2 (g) + 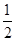 O2 (g)
O2 (g)  SO3 (g)����H�� ��99 kJ��mol-1
SO3 (g)����H�� ��99 kJ��mol-1
������1�����������2SO2 + O2  2SO3��
2SO3��
ʼ�� 2mol 2mol 0 mol
���� 2xmol xmol 2xmol
ƽ�� (2-2x) mol (2-x) mol 2xmol
�������У� ��֮�ã�x=0.8mol
��֮�ã�x=0.8mol
������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ��
���ݰ����ӵ����ɵ����ۣ�ͬ��ͬ��������£����ʵ���֮�ȵ���ѹǿ֮�ȣ��У�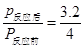 ��˷�Ӧ���ѹǿΪ��Ӧǰ��0.8����
��˷�Ӧ���ѹǿΪ��Ӧǰ��0.8����
��2���������ֹ�ϵ�������Ӧ���Dz����Ƿ�ﵽƽ��״̬һֱ���ڣ�����ȷ�����л��������ܶ�Ҳ��ʱ�̲���ģ���Ϊ��Ӧǰ�������壬�����غ㣬��������ǹ̶��ġ�����ȷ���۸÷�Ӧǰ������һ���������������������ʵ�����С�ķ���������Ǵﵽƽ���һ����Ҫ��־����ȷ���ܸ������Ũ�Ȳ��ٱ仯ʱ����ζ�Ÿ����Ũ��t1��һ��ֵ����ȷ��
��3��t1��t2ƽ�������ƶ���t3��t4ƽ�ⲻ�ƶ�t4 ��t5ƽ�������ƶ������ѡA
t3��t4���淴Ӧ����ͬ�ȳ̶ȸı䣬���÷�Ӧǰ��������ı䣬ֻ���Ǽ��������
�������ʱ�����������SO3���൱������ѹǿ��ƽ�������ƶ���
��4�������������2SO3  2SO2 + O2 ��
2SO2 + O2 ��
ʼ�� 2mol 0 mol 0 mol
���� 2x mol 2x mol x mol
ƽ�� (2-2x) mol (0+2x) mol L (0+x) mol
���ݰ����ӵ����ɵ����ۣ�ͬ��ͬѹ�����£����ʵ���֮�ȵ������֮�ȣ��У� ��֮�ã�x=0.4 ����ת����Ϊ40�G
��֮�ã�x=0.4 ����ת����Ϊ40�G
������K��A��B�ͳ���һ������������ٴδﵽƽ��ʱ�������Ӧ��Ϊ3��1.2aL=3.6aL����ȥA��ԭ����1L��B�������Ӧ����2.6aL��
��5�� �������У�1 mol��S��������1 mol��SO3��ų�592.5/1.5=395 kJ���������ٸ�駸�˹���ɿ�֪1 mol��SO2��g����������1 mol��SO3��g���ܷų�444-395="99" kJ����������ˣ�
2SO2 (g) + O2 (g)  2SO3 (g)����H�� ��198 kJ��mol-1
2SO3 (g)����H�� ��198 kJ��mol-1
���ߣ�SO2 (g) + 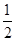 O2 (g)
O2 (g)  SO3 (g)����H�� ��99 kJ��mol-1
SO3 (g)����H�� ��99 kJ��mol-1
���㣺��ѧ��Ӧ���ʸ���ѧƽ�⾭�Լ���˹���ɵ����֪ʶ��

 ��������ܸ�ϰϵ�д�
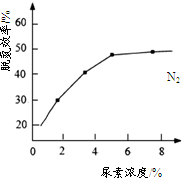
��������ܸ�ϰϵ�д������仯����������������������е���ϵ��������һ֧15mL���Թܣ�����NO������ˮ���У����Թ��л���ͨ��һ�������������Թ���Һ���ȶ�ʱ��ʣ������3mL����ͨ���������������Ϊ mL��
��Ŀǰ����������������Ⱦ�ж��ַ�����
��1����CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ��H="-574kJ/mol"
��CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ��H="-1160kJ/mol"
��H2O(g)= H2O(l) ��H=-44kJ/mol
д��CH4(g)��NO2(g)��Ӧ����N2(g) ��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ ��
��2���û���̿��ԭ��������������йط�ӦΪ��
ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T0C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�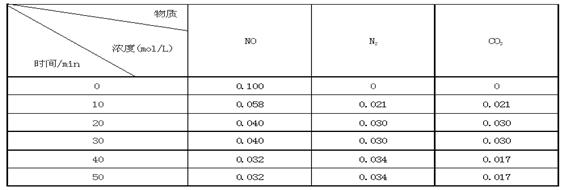
�ٲ�����Ϊ�жϷ�Ӧ�ﵽ��ѧƽ��״̬��������_______ ����ѡ����ĸ���ţ�
A��������CO2��Ũ�ȱ��ֲ���
B��v��(N2)="2" v��(NO)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
E����������ƽ����Է����������ֲ���
��ǰ20���ӣ�ƽ����Ӧ����v(NO)= ��v(NO)=��0��1- 0��04��/ 20 = 0��003mol��L-1�� min-1
����T0Cʱ���÷�Ӧ��ƽ�ⳣ��Ϊ_______(������λС��)��
����30 min���ı�ijһ������Ӧ���´ﵽƽ�⣬��ı��������_______ ��
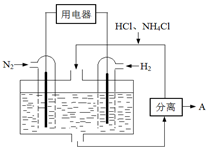
��3����ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2,�䷴ӦΪ�� 
�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�
| ʵ���� | T(0C) | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�� ��mol/L�� | �����ı� �����(m2/g) |
| �� | 280 | 1��20��10-3 | 5��80��10-3 | 82 |
| �� | a | b | c | 124 |
| �� | 350 | d | e | 124 |
�ϱ��У�a=_______,b=________,e=________ ��
I.��ѧ��һֱ�����ڡ��˹��̵����ķ����о���Ŀǰ�ϳɰ��ļ���ԭ��Ϊ�����������ڸ��¸�ѹ�������������ɰ�����һ�������£���һ��2L���ܱ������г���2molN2��6molH2����Ӧ��ƽ��ʱ����NH3��Ũ��Ϊ0.5mol/L�����ų�QkJ�������÷�Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ______��
II.��֪��N2O4(g) 2NO2(g) ��H����57.20kJ/mol��
2NO2(g) ��H����57.20kJ/mol��
��1000Cʱ����0.100molN2O4�������lL���ݳ�յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ�����Ũ�Ƚ��з����õ��±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ______���ӱ������ݷ�����c1______c2��c3______c4(ѡ�>������<����=������
(2)����ͼ�л����������˷�Ӧ��N2O4��NO2��Ũ����ʱ��仯�����ߡ�

(3)�����������£��ӷ�Ӧ��ʼ���ﵽ��ѧƽ��ʱ��������������ƽ����Ӧ����Ϊ______��
(4)����ʼʱ����NO2����0.200mol����ﵽƽ��ʱNO2�����ת����Ϊ______��������������ʱ�����д�ʩ�����NO2ת���ʵ���______ (����ĸ����
A.��СNO2��Ũ�� B.�����¶� C.����NO2��Ũ��
D.�����¶� E.�ٳ���һ������He
(5)���ݻ���ͬ���¶ȷֱ�ΪT1��T1�������ܱ������зֱ�������NO2��������Ӧ��2NO2
 N2O4(g)(g) ��H����57.20kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��NO2�İٷֺ����ֱ�Ϊa1��a2����֪T1<T2,��a1____a2(ѡ��A��B��C��D��գ���
N2O4(g)(g) ��H����57.20kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��NO2�İٷֺ����ֱ�Ϊa1��a2����֪T1<T2,��a1____a2(ѡ��A��B��C��D��գ���A.���� B.С�� C.���� D.���϶��п���
 CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
CH3OH(g)+H2O(g) ��H����49.0 kJ/mol��
 CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ�Т���������Ϊ�ϳ����а���ͬ��̼�� [n(NH3)/n(CO2)]��ˮ̼��[n(H2O)/n(CO2)]Ͷ��ʱ������̼ת���ʵ������
CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ�Т���������Ϊ�ϳ����а���ͬ��̼�� [n(NH3)/n(CO2)]��ˮ̼��[n(H2O)/n(CO2)]Ͷ��ʱ������̼ת���ʵ������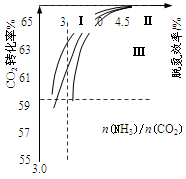
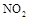 ��������
��������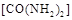 ��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��
��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��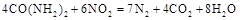 �������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
�������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��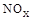 ��,�������з�������Ҫ��Ӧ�У�
��,�������з�������Ҫ��Ӧ�У�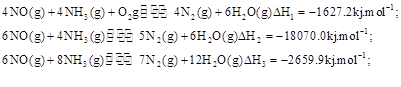
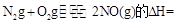 KJ/mol
KJ/mol ����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��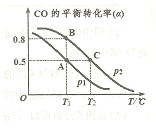
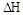 0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��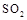 ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��
ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��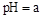 ����
����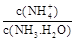 = ���ú�a�Ĵ���ʽ��ʾ����֪
= ���ú�a�Ĵ���ʽ��ʾ����֪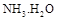 �ĵ��볣��
�ĵ��볣��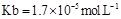 ����
����